题目内容
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
②1L 0.50mol?L-1 NH4Cl溶液与2L 0.25mol?L-1 NH4Cl溶液含NH4+物质的量完全相等
③pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
④pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
⑤pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
⑥pH=4、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
②1L 0.50mol?L-1 NH4Cl溶液与2L 0.25mol?L-1 NH4Cl溶液含NH4+物质的量完全相等
③pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
④pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
⑤pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
⑥pH=4、浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
| A、①②④ | B、①③⑤ |
| C、③⑤⑥ | D、②④⑥ |
考点:酸碱混合时的定性判断及有关ph的计算,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:①强酸稀释时氢氧根离子浓度增大;
②浓度越大水解程度越小;
③根据同浓度时的碱性强弱比较;
④PH=8.3,说明水解大于电离;
⑤pH=2的一元酸可能为强酸也可能是弱酸;
⑥pH=4浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中,电离大于水解.
②浓度越大水解程度越小;
③根据同浓度时的碱性强弱比较;
④PH=8.3,说明水解大于电离;
⑤pH=2的一元酸可能为强酸也可能是弱酸;
⑥pH=4浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中,电离大于水解.
解答:
解:①强酸溶液全部电离,加水稀释后,溶液中H+离子浓度一定都降低,氢离子和氢氧极根离子的浓度的乘积为定值,氢氢氧根离子浓度增大,故①错误;
②浓度越大水解程度越小,1L 0.50mol?L-1 NH4Cl溶液与2L 0.25mol?L-1 NH4Cl溶液含NH4+物质的量后者小,故②错误;
③四种盐的水溶液均显碱性,同浓度,碱性强弱顺序为d>b>c>a,故pH相等的四种溶液物质的量浓度由小到大顺序为d、b、c、a,故③正确;
④pH=8.3,溶液呈碱性,说明水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-)存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故④错误;
⑤pH=2的一元酸可能为强酸也可能是弱酸,强酸呈中性,弱酸呈酸性,故⑤正确;
⑥pH=4浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中,电离大于水解,c(Na+)>c(CH3COOH),电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故⑥正确;
故选C.
②浓度越大水解程度越小,1L 0.50mol?L-1 NH4Cl溶液与2L 0.25mol?L-1 NH4Cl溶液含NH4+物质的量后者小,故②错误;
③四种盐的水溶液均显碱性,同浓度,碱性强弱顺序为d>b>c>a,故pH相等的四种溶液物质的量浓度由小到大顺序为d、b、c、a,故③正确;
④pH=8.3,溶液呈碱性,说明水解大于电离,水解生成H2CO3而电离产生CO32-,钠离子不水解,HCO3-)存在两种趋势,但两种趋势都极其微弱,故离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故④错误;
⑤pH=2的一元酸可能为强酸也可能是弱酸,强酸呈中性,弱酸呈酸性,故⑤正确;
⑥pH=4浓度均为0.1mol?L-1的CH3COOH、CH3COONa混合溶液中,电离大于水解,c(Na+)>c(CH3COOH),电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故⑥正确;
故选C.
点评:本题考查较为综合,涉及弱电解质的电离、pH的计算、盐类的水解以及酸碱混合的定性判断和计算,题目难度中等.

练习册系列答案
相关题目
下列物质放入水中,会显著放热的是( )
| A、食盐 | B、生石灰 |
| C、硝酸铵 | D、蔗糖 |
下列离子方程式中,正确的是( )
| A、氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4 |
| B、氢氧化钡溶液跟盐酸反应:H++OH-=H2O |
| C、稀硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| D、石灰石溶解在稀HCl中:CO32-+2H+=CO2↑+H2O |
如图为某种甲醇燃料电池示意图,工作时电子流方向如图所示.下列判断正确的是( )
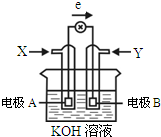

| A、X为氧气 |
| B、电极A反应式:CH3OH-6e-+H2O=CO2+6H+ |
| C、B电极附近溶液pH增大 |
| D、电极材料活泼性:A>B |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、28g氮气所含有的原子数目为NA |
| B、1mol铁与足量稀盐酸反应转移的电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、10g重水(2H216O)中含有的中子数目为5NA |
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L |
| B、10g D2O晶体中含有的氢氧键数目为NA |
| C、标准状况下,1 mol SO3分子体积约为22.4 L |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |