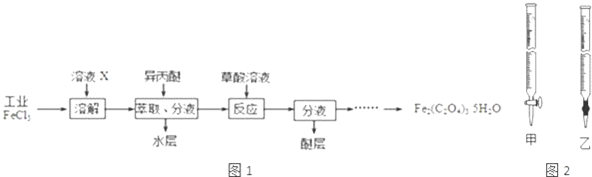
题目内容
18.在饱和Mg(OH)2溶液中,c(OH-)=1.0×10-4 mol/L,若向该溶液中加入NaOH溶液,使c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将( )| A. | 变为原来的10-3倍 | B. | 变为原来的10-2倍 | ||
| C. | 变为原来的10倍 | D. | 不发生变化 |
分析 饱和Mg(OH)2溶液中c(OH-)=2c(Mg2+),根据Ksp=c(Mg2+)•[c(OH-)]2计算氢氧化镁的溶度积,再计算加入氢氧化钠溶液后溶液中镁离子浓度,结合镁离子浓度计算.
解答 解:饱和Mg(OH)2溶液中c(OH-)=2c(Mg2+)=1.0×10-4 mol/L,故c(Mg2+)=5×10-5 mol/L,则
Ksp[Mg(OH)2]=c(Mg2+)•[c(OH-)]2=5×10-5×(1×10-4 )2=5×10-13,
向该溶液中加入NaOH溶液,使c(OH-)变为原来的10倍,即c′(OH-)=1.0×10-3 mol/L,而溶液中c′(Mg2+)=$\frac{5×1{0}^{-13}}{(1×1{0}^{-3})^{2}}$mol/L=5×10-7 mol/L,则Mg(OH)2的溶解度在理论上将变为原来的$\frac{5×1{0}^{-7}}{5×1{0}^{-5}}$=10-2倍,
故选:B.
点评 本题考查溶度积的有关计算,注意溶度积只受温度影响,根据浓度积与溶度积关系理解难溶电解质的溶解、析出与饱和状态.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
8.对于核电荷数为56的元素,下列描述正确的是( )
| A. | 其单质在常温下与水反应不如钙剧烈 | |
| B. | 其碳酸盐难溶于水 | |
| C. | 其主要化合价为+1价 | |
| D. | 其氢氧化物不能使Al(OH)3溶解 |
9.具有解热镇痛及抗生素作用的药物“芬必得”主要成分是结构简式如图,它属于( )

| A. | 芳香族化合物 | B. | 有机高分子化合物 | ||
| C. | 羧酸 | D. | 芳香烃 |
6.在实验中,下列说法不正确的是( )
| A. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| B. | 在Cl2制备实验中,用饱和食盐水除去Cl2中的HCl气体,用NaOH溶液吸收尾气 | |
| C. | 除去CO2气体中混有的少量HCl,可以将气体通入饱和NaHCO3溶液中 | |
| D. | H2在Cl2中燃烧火焰呈淡蓝色 |
13.下列实验不能获得成功的是( )
| A. | 溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去 | |
| B. | 硝基苯中混有的硫酸和硝酸可用NaOH溶液洗涤,再经分液而除去 | |
| C. | 苯中的少量苯酚可用NaOH溶液洗涤,再经分液而除去 | |
| D. | 苯中的少量苯酚可加入浓溴水,再经过滤而除去 |
 ;
;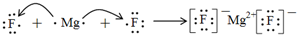 ;
;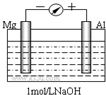 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验: