题目内容
在一定的条件下,将10molH2和1molN2充入一密闭容器中,在适当条件下使其发生反应:N2+3H2?2NH3,达到平衡后.则H2的转化率可能是( )
分析:假定氮气完全反应计算参加反应的氢气的物质的量,计算氢气转化率的极大值,由于反应是可逆反应,氮气不能完全反应,故氢气的实际转化率小于该极大值.
解答:解:假定1mol氮气完全反应,由方程式N2+3H2?2NH3可知,参加反应的氢气的物质的量为1mol×3=3mol,
故氢气转化率的极大值为:
×100%=30%,
由于反应是可逆反应,氮气不能完全反应,故氢气的实际转化率小于30%,
故选C.
故氢气转化率的极大值为:
| 3mol |
| 10mol |
由于反应是可逆反应,氮气不能完全反应,故氢气的实际转化率小于30%,
故选C.
点评:本题考查化学平衡的有关计算、可逆反应的特征等,难度不大,注意利用极值法解答.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
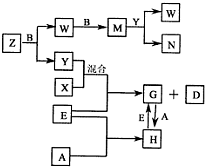 (2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(2012?南充模拟)A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
 5N2+6H2O
5N2+6H2O NH3?H2O+H+
NH3?H2O+H+
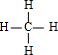
 +3H2
+3H2