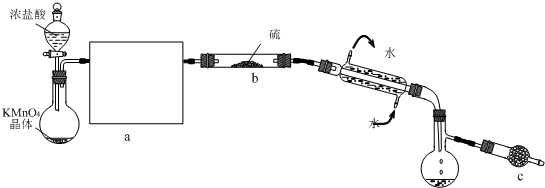
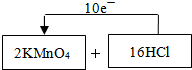
��Ŀ����
��12�֣���KMnO4��һ�ֳ��õ�ǿ����������ҵ�Ͽ��������̿���Ҫ�ɷ�MnO2��Ϊԭ�ϣ�ͨ��
Һ�෨���������ڼ�������������������MnO2�õ�K2MnO4�������õ�K2MnO4����
�������������������������K2MnO4��Һ�õ�KMnO4��������������������ʾ��

�ش��������⣺
��1��д����Ӧ���з�Ӧ�ķ���ʽ
��2���������������ʹ�ú�MnO280%���ϵĸ�����ΪMnO2������͵�ƶ����Al��
Si�������ﺬ���ϸߣ��ᵼ��KOH������ƫ�ߣ��÷���ʽ��ʾKOH����ƫ�ߵ�ԭ��
�� ��
��3��д�������������������ĵ缫��Ӧ����ʽ
������ �������� ��
�ڵ�ⷨ��ѭ���������õĹ�ͬ������ ��
��4���ڴ�ͳ�����У��õ�K2MnO4��������ͨ��CO2�Ʊ�KMnO4����ƽ����ʽ
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
����������Ӧ����MnԪ�صĽǶȿ���KMnO4�IJ������Ϊ ����ô�ͳ��
����ȣ���ⷨ�������� �� ��
��1��4KOH+2MnO2+O2=2K2MnO4+2H2O ��2�֣�
��2��2KOH+Al2O3=2KAlO2+H2O��2KOH+SiO2=K2SiO3+H2O����1�֣�
��3��������2H++2e��=H2������1�֣�
������2MnO42��-2e��=2MnO4- KOH��1�֣�
��4�� 3 K2MnO4+ 2 CO2= 2 KMnO4+ 1 MnO2+ 2 K2CO3��2�֣�
66.7%�����ʸ��ߡ�KOHѭ�����ã���1�֣�
��������

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�