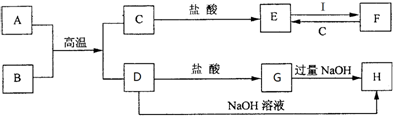
题目内容
11.下列离子方程式正确的是( )| A. | 常温下,将铁片置于足量浓硝酸中:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 在溶液中FeI2与氯气3:4反应:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| D. | 向Ba(OH)2溶液中加过量的NH4HSO4溶液:Ba2++2OH-+SO42-+H++NH4+═BaSO4↓+H2O+NH3•H2O |
分析 A.常温下铁与浓硝酸发生钝化反应;
B.向次氯酸钙溶液中通入少量SO2,发生氧化还原反应生成硫酸钙;
C.在溶液中FeI2与氯气3:4反应,电离子全部被氧化,亚铁离子部分被氧化;
D.由于NH4HSO4过量,溶液显酸性,无NH3•H2O存在.
解答 解:A.常温下铁与浓硝酸发生钝化反应,不能生成Fe2+,故A错误;
B.生成物HClO会将CaSO3氧化为CaSO4,离子反应为Ca2++3ClO-+H2O+SO2═CaSO4↓+Cl-+2HClO,故B错误;
C.在溶液中FeI2与氯气3:4反应,电离子全部被氧化,亚铁离子部分被氧化,反应的离子方程式为2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl-,故C正确;
D.由于NH4HSO4过量,溶液显酸性,无NH3•H2O存在,发生Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故D错误.
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意离子反应中保留化学式及电子、电荷守恒,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
2.下列实验方法或操作正确的是( )
| A. | 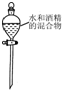 分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. | 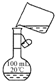 配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
6.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和S${O}_{4}^{2-}$的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
16.“基因剪刀”(酶)的合成和克隆,为化学治疗提供了一种全新的观念和途径.实验室在适宜的条件下,用含有过氧化氢酶的猪肝研磨液催化过氧化氢分解,比用FeCl3溶液催化过氧化氢分解的速率快得多,这说明与无机催化剂相比,酶具有的特性是( )
| A. | 专一性 | B. | 多样性 | C. | 高效性 | D. | 适应性 |
3.取少量无机盐溶液试样对其中的离子进行检验.下列判断正确的是( )
| A. | 加入盐酸,产生白色沉淀,则试样中一定有Ag+ | |
| B. | 加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-或HCO3- | |
| C. | 加入NaOH溶液微热,产生使湿润红色石蕊试纸变蓝气体,则试样中一定有NH4+ | |
| D. | 加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则试样中一定有SO42- |
20.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
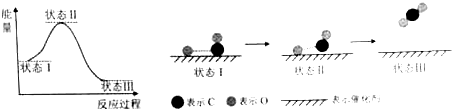
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
13.下列说法不正确的是( )
| A. | 在酸性条件下,CH3CO18 OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 乙醛和丙烯醛不是同系物,它们与H2充分反应后的产物是同系物 | |
| C. | 用溴水可以鉴别苯酚溶液、2,4-己二烯、甲苯和CCl4 | |
| D. | 乳酸薄荷醇酯(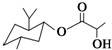 )能发生水解反应、氧化反应、消去反应、取代反应 )能发生水解反应、氧化反应、消去反应、取代反应 |