题目内容
11.(1)${\;}_{20}^{42}$Ca2+的质子数为20,电子数为18,中子数为22,质量数为42.(2)5.3gNa2CO3的物质的量是0.05mol,约含有Na+6.02×1022个.
(3)同温同压下的氮气和氢气,若体积相同时,两种气体的质量比14:1,其密度比为14:1;若质量相等时,两种气体的体积比为1:14.
分析 (1)Ca的质子数为20,质量数为42,质子数+中子数=质量数,离子的电子数=质子数-2;
(2)结合n=$\frac{m}{M}$、N=nNA及物质构成计算;
(3)同温同压下,Vm相同,由n=$\frac{V}{Vm}$可知,体积相同时,物质的量相同,结合m=nM、ρ=$\frac{M}{Vm}$计算;若质量相等时,结合V=$\frac{m}{M}$×Vm计算.
解答 解:(1)${\;}_{20}^{42}$Ca2+的质子数为20,电子数为20-2=18,中子数为42-20=22,质量数为42,故答案为:20;18;22;42;
(2)5.3gNa2CO3的物质的量是$\frac{5.3g}{106g/mol}$=0.05mol,约含有Na+为0.05mol×2×NA=6.02×1022个,故答案为:0.05mol;6.02×1022;
(3)同温同压下,Vm相同,由n=$\frac{V}{Vm}$可知,体积相同时,物质的量相同,两种气体的质量比等于摩尔质量之比,为28g/mol:2g/mol=14:1,其密度比等于摩尔质量之比,为28g/mol:2g/mol=14:1; 若质量相等时,两种气体的体积比与气体的摩尔质量成反比,为1:14,
故答案为:14:1;14:1;1:14.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成及物质的量为中心的基本计算公式等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.下列关于有机化合物的说法正确的是( )
| A. | 甲烷和乙烯都可以与氯气反应 | |
| B. | 酸性高锰酸钾可以氧化苯和甲苯 | |
| C. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 | |
| D. | 溴乙烷在NaOH的醇溶液中充分反应可得到乙醇 |
2.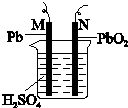 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )| A. | 充电时,阳极的电极反应式为:PbSO4+2e-═Pb+SO42- | |
| B. | 充电时,若N连接电源正极,则该极生成PbO2 | |
| C. | 放电时,c(H2SO4)不变,两极的质量增加 | |
| D. | 放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-═PbSO4+2H2O |
6.下列说法中正确的是( )
| A. | 在任何状况下,1 mol CO2和1 mol H2O所含的分子数和原子数都相等 | |
| B. | 只有在标准状况下,1 mol气体所占的体积才是22.4 L | |
| C. | 某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 L | |
| D. | 22.4 L CO所含的分子数为6.02×1023个 |
16.下列说法正确的是( )
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| B. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| C. | pH相等NaOH与Ba(OH)2的溶液中c(OH-)之比为1:2 | |
| D. | 0.1mol/L醋酸与0.1mol/L醋酸钠溶液中c(CH3COO-)之比为1:1 |
20.表是某食品包装上的说明,表中列出了部分配料.
上表所列配料中,属于防腐剂的是④(填序号,下同),属于维生素的是③,属于调味剂的是②,富含蛋白质的是①.
| 品 名 | 火腿 |
| 配 料 | ①精选瘦肉 ②食盐 ③VC ④亚硝酸钠等 |
| 保质期 | 0℃~4℃30天 |
| 生产日期 | 见包装封口处 |
1.现代建筑的门框架,常用古铜色的硬铝制造.硬铝含有的元素是( )
| A. | Al、Mg | B. | Al、Si | C. | Al、Cu、Mn、Si | D. | Al、Zn |
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.