题目内容
某活动小组探究某无色晶体(纯净物)的组成.先测得相对分子质量为126;经元素分析可知:只含碳、氢、氧三种元素;该无色晶体受热能分解.然后设计了下列实验方案再对其进行定量分析:
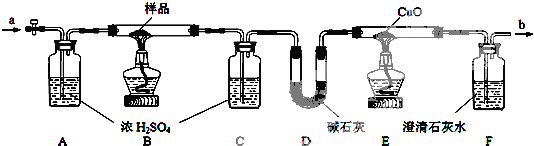
【实验操作】
①检查装置的气密性;
②在相应的仪器中放入相应的试剂,并称量C、D、E的质量;
③先从a处通入足量的N2,排尽装置中的空气;
④点燃B、E两处的酒精灯,缓缓加热样品,使之发生分解反应;
⑤当样品完全分解后,先熄灭B处的酒精灯,从a处缓缓通入足量的N2,再熄灭E处酒精灯;
⑥冷至室温,拆下各仪器,并称量C、D、E的质量.
【实验现象】①E处有红色物质生成,F处有白色沉淀生成;
②由于实验条件控制得好,b处无可燃性气体放出.
请回答下列问题:
(1)该无色晶体受热分解的产物可能是
(2)仪器A的作用是
(3)操作③和⑤若是通入空气,其后果是 (合理即可)
(4)数据处理:
①实验记录的数据(各仪器中的吸收或反应都很完全):
②计算判断:样品(无色晶体)的分子式为 .

【实验操作】
①检查装置的气密性;
②在相应的仪器中放入相应的试剂,并称量C、D、E的质量;
③先从a处通入足量的N2,排尽装置中的空气;
④点燃B、E两处的酒精灯,缓缓加热样品,使之发生分解反应;
⑤当样品完全分解后,先熄灭B处的酒精灯,从a处缓缓通入足量的N2,再熄灭E处酒精灯;
⑥冷至室温,拆下各仪器,并称量C、D、E的质量.
【实验现象】①E处有红色物质生成,F处有白色沉淀生成;
②由于实验条件控制得好,b处无可燃性气体放出.
请回答下列问题:
(1)该无色晶体受热分解的产物可能是
(2)仪器A的作用是
(3)操作③和⑤若是通入空气,其后果是
(4)数据处理:
①实验记录的数据(各仪器中的吸收或反应都很完全):
| 样品的质量 | C装置增重 | D装置增重 | E装置减轻 |
| 12.6g | 5.4g | 4.4g | 1.6g |
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)从装置图可知,浓硫酸用来吸水水分,故浓硫酸增重说明有水生成,碱石灰吸收二氧化碳,故碱石灰增重说明有二氧化碳生成,E处有红色物质生成,F处有白色沉淀生成,说明有还原性气体一氧化碳生成;
(2)根据浓硫酸的性质和作用分析;
(3)根据实验现象推定反应后的气体中含有还原性气体,若通入空气,可能造成爆炸事故;空气中的成分可能被D装置吸收;
(4)C装置增重5.4g为水的质量,D装置增重4.4g为二氧化碳的质量,E装置减轻1.6g为氧化铜中氧的质量,据此可计算出一氧化碳的物质的量,根据质量守恒可样品中计算碳、氢的物质的量,根据样品质量可计算出氧的物质的量,进而算出原子个数比,由相对分子质量可计算分子式.
(2)根据浓硫酸的性质和作用分析;
(3)根据实验现象推定反应后的气体中含有还原性气体,若通入空气,可能造成爆炸事故;空气中的成分可能被D装置吸收;
(4)C装置增重5.4g为水的质量,D装置增重4.4g为二氧化碳的质量,E装置减轻1.6g为氧化铜中氧的质量,据此可计算出一氧化碳的物质的量,根据质量守恒可样品中计算碳、氢的物质的量,根据样品质量可计算出氧的物质的量,进而算出原子个数比,由相对分子质量可计算分子式.
解答:
解:(1)从装置图可知,浓硫酸用来吸水水分,故浓硫酸增重说明有水生成,碱石灰吸收二氧化碳,故碱石灰增重说明有二氧化碳生成,E处有红色物质生成,F处有白色沉淀生成,说明有还原性气体一氧化碳生成,因此该无色晶体受热分解的产物可能是:CO、CO2、H2O;
故答案为:CO、CO2、H2O;
(2)浓硫酸具有吸水性,通入的氮气在A中被干燥,防止干扰产物水的测定,故答案为:除去N2中的水蒸气;
(3)根据实验现象推定反应后的气体中含有还原性气体一氧化碳,一氧化碳具有可燃性,若通入空气,可能造成爆炸事故;空气中的二氧化碳等气体可被D装置吸收,导致测定的质量偏大,
故答案为:根据实验现象推定反应后的气体中含有还原性气体,若通入空气,可能造成爆炸事故;使D装置中测定的质量偏大(答爆炸或有误差即可);
(4)C装置增重5.4g为水的质量,物质的量:
=0.3mol,n(H)=0.6mol,D装置增重4.4g为二氧化碳的质量,物质的量为:
=0.1mol,n(C)=0.1mol,E装置减轻1.6g为氧化铜中氧的质量,物质的量为:
=0.1mol,根据反应方程式:CuO+CO
Cu+CO2,可知一氧化碳的物质的量也为0.1mol,n(C)=0.1mol+0.1mol=0.2mol,样品中氧的质量为:12.6g-1g/mol×0.6mol-12g/mol×0.2mol=9.6g,物质的量为:n(O)=
=0.6mol,n(C):n(H):n(O)=0.2mol:0.6mol:0.6mol=1:3:3,实验式为:CH3O3,设分子式为:CnH3nO3n,则12n+3n+48n=126,解得n=2,故该样品分子式为:C2H6O6,
故答案为:C2H6O6.
故答案为:CO、CO2、H2O;
(2)浓硫酸具有吸水性,通入的氮气在A中被干燥,防止干扰产物水的测定,故答案为:除去N2中的水蒸气;
(3)根据实验现象推定反应后的气体中含有还原性气体一氧化碳,一氧化碳具有可燃性,若通入空气,可能造成爆炸事故;空气中的二氧化碳等气体可被D装置吸收,导致测定的质量偏大,
故答案为:根据实验现象推定反应后的气体中含有还原性气体,若通入空气,可能造成爆炸事故;使D装置中测定的质量偏大(答爆炸或有误差即可);
(4)C装置增重5.4g为水的质量,物质的量:
| 5.4g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 1.6g |
| 16g/mol |
| ||
| 9.6g |
| 16g/mol |
故答案为:C2H6O6.
点评:本题考查了有机物分子式的确定,中等难度,注意从所给试剂和装置特点分析分解产物,根据数据计算分子式.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列材料属于硅酸盐材料的是( )
| A、不锈钢 | B、光纤 | C、水泥 | D、塑料 |
下列反应的离子方程式正确的是( )
| A、铁粉投醋酸溶液中:Fe+2H+=Fe2++H2↑ |
| B、Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- |
| C、氢氧化钡溶液中滴加硫酸氢钠溶液至恰好为中性:Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O |
| D、向饱和澄清石灰水中加入纯碱溶液:Ca(OH)2+CO32-=CaCO3↓+2OH- |
 Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2
Fenton法常用于处理含难降解有机物的工业废水,通常先调节好Fe2+等离子的浓度,再向废水中加入H2O2,所产生的羟基自由基(Fe2++H2O2→Fe3++OH-+HO?)能氧化降解污染物.如:降解废水中丙二醇(分子式C3H8O2)的反应为:C3H8O2+8H2O2 某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,为了测定此样品纯度,甲同学设计了如图所示装置和实验方案.实验步骤如下:

 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.