题目内容
【题目】乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是

A. 常温下,pKb2=-1gKb2 =7.15
B. 溶液中水的电离程度:a点大于b点
C. H3NCH2CH2NH2Cl2 溶液中c(H+)>c(OH-)
D. 曲线G代表pH 与![]() 的变化关系
的变化关系
【答案】B
【解析】二元弱碱的电离第一步电离大于第二步电离,氢氧根离子浓度第一步电离的大,故曲线G代表pH与![]() 的变化关系,选项D正确;参照pH的计算,常温下,b点时
的变化关系,选项D正确;参照pH的计算,常温下,b点时![]() =0, pKb2=-1gKb2=14-pH=7.15,选项A正确;a点pH大于b点,氢氧根离子浓度较大,对水的电离抑制程度大,故溶液中水的电离程度:a点小于b点,选项B不正确;H3NCH2CH2NH2Cl2为强酸弱碱盐,水解溶液中c(H+)>c(OH-),选项C正确。答案选B。
=0, pKb2=-1gKb2=14-pH=7.15,选项A正确;a点pH大于b点,氢氧根离子浓度较大,对水的电离抑制程度大,故溶液中水的电离程度:a点小于b点,选项B不正确;H3NCH2CH2NH2Cl2为强酸弱碱盐,水解溶液中c(H+)>c(OH-),选项C正确。答案选B。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】氢在生活、生产、科研中发挥着重要的作用。
Ⅰ.工业上利用吸热反应C(s) +2H2O(g)![]() CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
CO2(g)+2H2(g)来制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,相关数据如下表:
容器 | 容积/L | 温度/L | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
(l)T1_______T2 (填“>”、“ =”或“<”)。
(2)T1时达到平衡后再加入lmolH2O(g),达到新平衡后H2(g)的物质的量分数__________(填“增大”、“ 不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v(正)________v(逆)(填“大 于”、“ 等 于” 或“小于”)。
Ⅱ.CO(g)和H2(g)在一定条件下可合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(3)该反应能量变化曲线如图所示,下列叙述正确的是___________。

A.该反应的△H>0
B.该反应的活化能为419kJ
C.使用催化剂后反应速率加快,△H 不变
D.若改变条件使平衡向正反应方向移动,则CO 的转化率可能增大,可能不变,也可能减小
(4)反应分別在230℃、250℃、270℃进行时,CO的平衡转化率与![]() 的关系如图所示。
的关系如图所示。
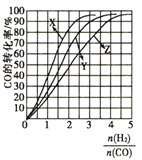
①230℃对应的曲线是_________________,依据是________________。
②向容积为1L的密闭容器中投入1nolCO、3molH2,在上述某温度下进行反应,平衡后测得![]() =
=![]() ,则反应温度为_____________,平衡常数K=_________________。
,则反应温度为_____________,平衡常数K=_________________。