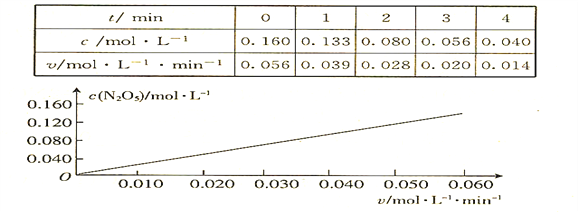
题目内容
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
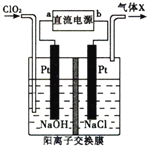
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
【答案】C
【解析】A、左边通入ClO2,ClO2得电子产生ClO2-,故左边电极为阴极,连接电源的负极,铅蓄电池Pb极为负极,则a极为Pb,选项A错误;B. 阳极氯离子失电子产生氯气,电极反应式为2Cl--e-=Cl2,选项B错误;C. 交换膜左测NaOH不参与电极反应,物质的量不变,根据选项B分析气体X为Cl2,选项C正确;D. 电解池中阳离子向阴极移动,则制备18.1gNaClO2即0.2mol时理论上有0.2molNa+由交换膜右侧向左侧迁移,选项D错误。答案选C。

练习册系列答案
相关题目