题目内容
3.常温下,下面物质可用铁制或铝制容器盛放的是( )| A. | 浓盐酸 | B. | 硫酸铜溶液 | C. | 稀硫酸 | D. | 浓硫酸 |
分析 浓硫酸、浓硝酸具有强的氧化性,常温下遇到铁和铝能够发生钝化生成致密氧化膜,阻止反应进行,据此解答.
解答 解:A.铁和铝都能够与盐酸反应,被盐酸腐蚀,所以不能用铁制或铝制容器盛放,故A错误;
B.铁、铝性质强于铜,与硫酸铜溶液都能够反应,所以不能用铁制或铝制容器盛放,故B错误;
C.铁和铝都能够与硫酸反应,被硫酸腐蚀,所以不能用铁制或铝制容器盛放,故C错误;
D.浓硫酸、浓硝酸具有强的氧化性,常温下遇到铁和铝能够发生钝化生成致密氧化膜,阻止反应进行,所以可用铁制或铝制容器盛放,故D正确;
故选:D.
点评 本题考查了元素化合物的性质,熟悉浓硫酸、浓硝酸的强的氧化性是解题关键,注意钝化属于化学变化,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列方法中可以说明2HI(g)?H2(g)+I2(g)已达到平衡的标志是( )
| A. | c(HI):c(H2):c(I2)=2:1:1时 | |
| B. | 温度和体积一定时,容器内压强不再变化 | |
| C. | 条件一定,混合气体的平均相对分子质量不再变化 | |
| D. | 温度和体积一定时,混合气体的颜色不再变化 |
11.下列各组微粒中,核外电子总数相等的是( )
| A. | O3和CO2 | B. | OH-和Al3+ | C. | NO和CO | D. | Cl-和Ne |
18.下列各组物质中,分子数相同的一组是( )
| A. | 2LCO和2LCO2 | B. | 标准状况下22.4LH2O和1mol O2 | ||
| C. | 0,4克H2和4.48L HCl | D. | 18克水和标准状况下22.4L CO2 |
12.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:
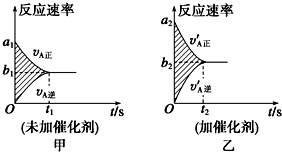
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
①30min时,反应到达平衡状态了吗?是(填“是”或“否”)简述理由从20min到30min时各物质的浓度没有发生改变
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
Ⅰ脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在恒温恒容的条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
(1)该反应v-t图象如图甲所示;若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.现有下列叙述:

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2.
则以上所述各项正确的组合为B
A.②④⑥B.②④⑤C.②③⑤D.②③⑥
(2)下列叙述能说明此反应达到平衡状态的是abe.
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
(3)该反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 0 min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
②前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,平衡时H2的浓度c(H2)=1.5mol•L-1,平衡时CO2的转化率=50%
③在其它条件不变下,若20min时往密闭容器中通入1mol氖气,此时该反应速率将不变(填“变大”、“变小”或“不变”,下同);若20min时往密闭容器中通入1mol氢气,此时该反应速率将变大.
9.下列有机物中满足要求的同分异构体的种类最多的是( )
| A. | C5H12 | |
| B. | C3H7Cl | |
| C. | C5H10O2酯类的同分异构体 | |
| D. | 含有一个碳碳双键的分子式为C3H4Cl2的同分异构体 |
10.下列各组物质性质的比较中,正确的是( )
| A. | 热稳定性:NH3<PH3<H2O | |
| B. | P元素最高价氧化物对应的水化物酸性比Cl的强 | |
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 元素非金属性:O>F |
