题目内容
 S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构如图所示.下列说法错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构如图所示.下列说法错误的是( )| A、S2Cl2的结构中各原子都达到了八电子稳定结构 |
| B、S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2 |
| C、S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
考点:氯、溴、碘及其化合物的综合应用,化学键,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构,元素及其化合物
分析:A、由结构可知,S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,写出电子式确定每个原子周围的电子数;
B、组成与结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高;
C、同种元素原子之间形成非极性键,不同元素的原子之间形成的化学键为极性键;
D、S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应中硫元素一部分升高到+4价,生成SO2,一部分降低到0价,生成S.
B、组成与结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高;
C、同种元素原子之间形成非极性键,不同元素的原子之间形成的化学键为极性键;
D、S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应中硫元素一部分升高到+4价,生成SO2,一部分降低到0价,生成S.
解答:
解:A、S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,S2Cl2的电子式为  ,每个原子周围都满足8电子稳定结构,故A正确;
,每个原子周围都满足8电子稳定结构,故A正确;
B、组成与结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高,故B正确;
C.S2Cl2分子中S-S为非极性键,S-Cl键为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故C错误;
D.S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价,生成SO2,一部分降低到0价生成S,符合氧化还原反应原理,故D正确.
故选:C.
 ,每个原子周围都满足8电子稳定结构,故A正确;
,每个原子周围都满足8电子稳定结构,故A正确;B、组成与结构相似,相对分子质量越大,分子间作用力越强,熔沸点越高,故B正确;
C.S2Cl2分子中S-S为非极性键,S-Cl键为极性键,S2Cl2是展开书页型结构,Cl-S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故C错误;
D.S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价,生成SO2,一部分降低到0价生成S,符合氧化还原反应原理,故D正确.
故选:C.
点评:本题以S2Cl2的结构为载体,考查分子结构、化学键、电子式、氧化还原反应等,难度不大,是对基础知识的综合运用与学生能力的考查,注意基础知识的全面掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧.下列有关说法不正确的是( )
| A、Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂 |
| B、1mol过氧化钠中阴离子数目为1NA |
| C、过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性 |
| D、过氧化钠与二氧化硫反应时可生成硫酸钠 |
某有机物结构为: ,用系统命名法得到的名称是( )
,用系统命名法得到的名称是( )
 ,用系统命名法得到的名称是( )
,用系统命名法得到的名称是( )| A、2-乙基丙烷 |
| B、2-甲基丁烷 |
| C、3-甲基丁烷 |
| D、新戊烷 |
在恒温恒容的密闭容器中发生反应:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g).下列说法正确的是( )
A、该反应的平衡常数表达式K=
| ||
| B、若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态 | ||
| C、若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | ||
| D、若初始时投入4.64g Fe3O4与一定量H2,反应达平衡时容器内固体共有4g,则Fe3O4的转化率为50% |
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Cu2+、NH4+、SO42-、OH- |
| B、Ag+、NO3-、Cl-、K+ |
| C、H+、Al3+、NO3-、Cl- |
| D、H+、Na+、NO3-、Fe2+ |
下列有关说法正确的是( )
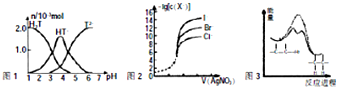

| A、常温下,向20mL 0.1mol?L-1酒石酸(H2T)溶液中添加0.1mol?L-1 NaOH溶液,有关微粒的物质的量与混合溶液的pH关系如图1,则H2T的酸性比H2CO3强 |
| B、用0.0100mol?L-1硝酸根标准溶液,滴定浓度均为0.100mol?L-1的Cl、Br及I的混合溶液,由图2曲线可确定首先沉淀的是Cl- |
| C、碳酸氢钠溶液中存在:c(H+)+2c(H2CO3)=c(OH-)+2c(CO32-) |
| D、由图3可说明烯烃与H2加成反应,虚线表示在催化剂的作用下进行 |
在托盘天平的两个托盘上分别放有同样大小的两个烧杯,烧杯内部分别装有等量盐酸,天平保持平衡.这时,分别向两个烧杯中加入等质量的下列物质,充分反应后(酸过量),天平仍能保持平衡的是( )
| A、CaCO3和KHCO3 |
| B、Na2CO3和NaHCO3 |
| C、Na2CO3和K2CO3 |
| D、Na2CO3和CaCO3 |
 通过计算得到:
通过计算得到: