题目内容
将一定质量的镁和铝混合物投入200mL一定浓度的稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示.
 通过计算得到:
通过计算得到:
(1)镁和铝混合物的总质量为 g
(2)硫酸的物质的量浓度为 mol?L-1.
 通过计算得到:
通过计算得到:(1)镁和铝混合物的总质量为
(2)硫酸的物质的量浓度为
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:(1)从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由元素守恒可知金属镁和铝放热物质的量,进而计算质量即可.
(2)溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
倍,据此计算硫酸的物质的量,进而计算浓度大小.
(2)溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
| 1 |
| 2 |
解答:
解:(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,故答案为:9;
(2)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
倍,所以n(Na2SO4)=
×0.2L×5mol/L=0.5mol,所以硫酸的浓度为
=2.5mol/L,故答案为:2.5.
(2)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的
| 1 |
| 2 |
| 1 |
| 2 |
| 0.5mol |
| 0.2L |
点评:本题考查镁铝的重要化合物及计算,为高频考点,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
有机物结构式可以简化,如: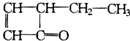 可表示为
可表示为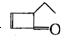 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
 可表示为
可表示为 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A、6种 | B、5种 | C、4种 | D、3种 |
有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:
甲 乙
乙
甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
甲
 乙
乙甲:a(g)+b(g)?2c(g)△H1<0 乙:x(g)+3y(g)?2z(g)△H2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是( )
| A、绝热下向甲中通入惰性气体,c的物质的量不变 |
| B、绝热下向乙中通入z气体,反应器中温度升高 |
| C、恒温下向甲中通入惰性气体,甲中平衡不移动,乙中X、Y的转化率增大 |
| D、恒温下向乙中通入z气体,y的物质的量浓度增大 |
C+CO2?2CO;△H1>0,反应速率v1,N2+3H2?2NH3;△H2<0,反应速率v2.如升温,v1和v2的变化是( )
| A、同时增大 |
| B、同时减少 |
| C、v1增大,v2减少 |
| D、v1减少,v2增大 |
完成下列实验,所选装置正确的是( )
| A | B | C | D | |
| 实验 目的 | 实验室 制备乙烯 | 分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃) | 分离KCl和NH4Cl固体混合物 | 实验室用纯碱和稀硫酸制备二氧化碳 |
| 实验装置 |  |  | 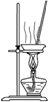 | 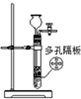 |
| A、A | B、B | C、C | D、D |
下列行为中符合安全要求的是( )
| A、节日期间,在开阔的广场燃放烟花爆竹 |
| B、进入煤矿井时,用火把照明 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、稀释浓硫酸时,将水倒入装浓硫酸的烧杯中 |
将自来水加工成蒸馏水过程中,没有涉及到的过程或变化是( )
| A、化学变化 | B、冷凝 |
| C、蒸发 | D、物理变化 |
贝诺酯具有抗风湿、解热镇痛作用,其结构简式如图,下列说法正确的是( )


| A、贝诺酯可与水任意比互溶 |
| B、贝诺酯可发生取代反应、消去反应和聚合反应 |
| C、1mol贝诺酯最多可与9molH2发生加成反应 |
| D、贝诺酯完全水解后能得到3种物质 |
 S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构如图所示.下列说法错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构如图所示.下列说法错误的是( )| A、S2Cl2的结构中各原子都达到了八电子稳定结构 |
| B、S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2 |
| C、S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |