题目内容
11.下列各物质所含原子数由大到小顺序排列的是( )①0.5mol NH3 ②4g H2 ③4℃时9mL H2O ④0.2mol H3PO4.
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ②①④③ |
分析 根据N=nNA,结合每个分子含有的原子数目计算含有原子总物质的量,注意分子的组成,据此解答.
解答 解:①0.5mol NH3所含原子的物质的量为:0.5mol×4=2mol;
②4g H2的物质的量为$\frac{4}{2}$=2mol,2mol H2所含原子的物质的量为:2mol×2=4mol;
③9mL H2O的物质的量为:$\frac{9g}{18g/mol}$=0.5mol,0.5mol H2O所含原子的物质的量为:0.5mol×3=1.5mol;
④0.2mol H3PO4所含原子的物质的量为:0.2mol×8=1.6mol;所以原子个数按由大到小的顺序为②①④③,故选D.
点评 本题考查物质的量有关计算、微粒数目计算,比较基础,注意理解化学式的意义.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
4.二氧化碳和钠在一定条件下可制得金刚石,其化学方程式为3CO2+4Na═2X+C(金刚石).设NA为阿伏加德罗常数的值,下列有关此反应的叙述中,不正确的是( )
| A. | 1 mol C(金刚石)中含有C-C键的数目为2NA | |
| B. | 当有0.4 mol Na参与反应时,被还原的CO2为0.3NA | |
| C. | 金刚石与石墨之间的转化为化学变化 | |
| D. | X的化学式为Na2CO3 |
5.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
(1)加入少量NaHCO3的目的是调节PH,除去溶液中Al3+(使溶液中Al3+生成氢氧化物沉淀),该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行.
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为
D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为
D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
6.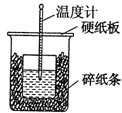 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
(6)下列操作能引起△H偏大的是:①②③(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是:碎纸条未填满,大小烧杯杯口未相平.
(3)若实验中改用50mL 0.55mol•L-1醋酸溶液进行反应,与上述实验相比,所放出的热量减小(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55mol•L-1硫酸与25mL 0.50mol•L-1Ba(OH)2溶液代替上述反应,所求得的中和热△H偏小 (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1g•cm-3,反应后混合溶液的比热容c=4.18J•(g•℃)-1.实验数据如表:根据上表中所测数据,通过计算得到中和热△H=-56.8kJ/mol(保留一位小数).
| 实验 次数 | 起始温度t1/℃ | 终止温度t2/℃] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.6 |
| 2 | 20.3 | 20.3 | 23.7 |
| 3 | 20.3 | 20.3 | 25.9 |
| 4 | 20.3 | 20.3 | 23.8 |
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
16.下列物质的转化均能通过一步反应实现的是( )
| A. | NaAlO2→Al(OH)3→Al | B. | N2→NO2→HNO3 | ||
| C. | NaOH→Na2CO3→NaHCO3 | D. | FeS2→SO3→H2SO4 |
3.除去下列物质中的杂质,选用的方法或试剂正确的是( )
| 选项 | 物质 | 杂质 | 除去杂质所用的试剂和方法 |
| A | 碳酸钠粉末 | 碳酸钙粉末 | 加足量水过滤、蒸发 |
| B | 二氧化碳 | 氧气 | 点燃混合气体 |
| C | 铁 | 氧化铁 | 加足量盐酸蒸发 |
| D | 氯化铁溶液 | 氯化铜 | 加足量铁粉过滤 |
| A. | A | B. | B | C. | C | D. | D |
20.两份铝屑,第一份与足量稀盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1:2,则第一份与第二份铝屑的质量比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 1:2 |
1.若NA代表阿伏伽德罗常数,则下列有关阿伏伽德罗常数的说法正确的是( )
| A. | 1molNa与足量氧气充分反应转移电子数目为NA | |
| B. | 1L0.1mol/LHCl溶液中含0.1NAHCl分子 | |
| C. | 100ml 1mol/L盐酸与0.1molNa2CO3无论如何滴加都产生0.05NA的CO2分子 | |
| D. | 0.1mol/L的AlCl3中Cl-的物质的量为0.3NA |
 从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应.试回答:
从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应.试回答: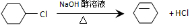 ;
; .
. ,C
,C .
.