题目内容
用标准NaOH溶液测定未知盐酸溶液的浓度.
(1)配制0.5mol/LNaOH溶液250mL所需的玻璃仪器为 .
(2)用滴定管准确量取20.00mL未知浓度盐酸于锥形瓶中,加入几滴酚酞作指示剂,用NaOH溶液滴定到终点,滴定终点的判断是 .
(3)某学生进行了三次实验,实验数据如下表:
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 .
A.滴定管在装标准NaOH溶液前未润洗
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干
E.达到滴定终点时,俯视溶液凹液面最低点读数
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
G.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得盐酸溶液的物质的量浓度为 (结果保留三位小数).
(1)配制0.5mol/LNaOH溶液250mL所需的玻璃仪器为
(2)用滴定管准确量取20.00mL未知浓度盐酸于锥形瓶中,加入几滴酚酞作指示剂,用NaOH溶液滴定到终点,滴定终点的判断是
(3)某学生进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
A.滴定管在装标准NaOH溶液前未润洗
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干
E.达到滴定终点时,俯视溶液凹液面最低点读数
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
G.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得盐酸溶液的物质的量浓度为
考点:中和滴定
专题:
分析:(1)配制250mL一定物质的量浓度的溶液所需玻璃仪器有:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(2)酚酞遇酸不变色,遇碱变红色;
(3)第一次实验误差较大,从造成读数偏大的原因分析;
(4)据c(待测)=
求算.
(2)酚酞遇酸不变色,遇碱变红色;
(3)第一次实验误差较大,从造成读数偏大的原因分析;
(4)据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)配制250mL一定物质的量浓度的溶液所需玻璃仪器有:烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(2)用NaOH溶液滴定加有酚酞的盐酸溶液,滴定终点时:溶液由无色变为粉红色,且30S不变色,故答案为:溶液由无色变为粉红色,且30S不变色;
(3)第一次实验误差较大,消耗NaOH溶液的体积太多,
A.滴定管在装标准NaOH溶液前未润洗,导致浓度降低,消耗体积增大,故正确;
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡,导致V(标准)偏大,故正确;
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,导致V(标准)偏小,故错误;
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干,对滴定结果无影响,故错误;
E.达到滴定终点时,俯视溶液凹液面最低点读数,导致V(标准)减小,故错误;
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来,导致V(标准)减小,故错误;
G.滴定到终点时,溶液颜色由无色变到了红色,导致V(标准)偏大,故正确;
故答案为:1;ABG;
(4)消耗标准溶液的体积为:V(标准)=
mL=17.00mL,c(待测)=
=
=0.425 mol/L,
故答案为:0.425 mol/L.
(2)用NaOH溶液滴定加有酚酞的盐酸溶液,滴定终点时:溶液由无色变为粉红色,且30S不变色,故答案为:溶液由无色变为粉红色,且30S不变色;
(3)第一次实验误差较大,消耗NaOH溶液的体积太多,
A.滴定管在装标准NaOH溶液前未润洗,导致浓度降低,消耗体积增大,故正确;
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡,导致V(标准)偏大,故正确;
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,导致V(标准)偏小,故错误;
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干,对滴定结果无影响,故错误;
E.达到滴定终点时,俯视溶液凹液面最低点读数,导致V(标准)减小,故错误;
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来,导致V(标准)减小,故错误;
G.滴定到终点时,溶液颜色由无色变到了红色,导致V(标准)偏大,故正确;
故答案为:1;ABG;
(4)消耗标准溶液的体积为:V(标准)=
| 17.10+16.90 |
| 2 |
| c(标准)×V(标准) |
| V(待测) |
| 0.5mol/L×0.01700L |
| 0.0200L |
故答案为:0.425 mol/L.
点评:本题考查了一定物质的量浓度溶液的配制、中和滴定中滴定终点的判断、中和滴定中的误差分析、滴定计算,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
有关化学用语表达,下列正确的是( )
A、CS2的比例模型: |
B、铍原子最外层的电子云图: |
| C、石英的分子式:SiO2 |
D、氮原子最外层轨道表示式: |
下列有关说法错误的是( )
| A、常用丁达尔效区分溶液与胶体 |
| B、在铜锌原电池中,负极上发生Zn-2e-═Zn2+ |
| C、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均减少 |
| D、向AgCl沉淀中滴加KI溶液,沉淀变为黄色,说明Ksp(AgCl)>Ksp(AgI) |
下列各组离子在水溶液中能够大量共存的是( )
| A、OH-、SO42-、Fe3+ |
| B、NH4+、OH-、NO3- |
| C、Na+、Cl-、SO42- |
| D、H+、HCO3-、K+ |
胶体是一种重要的分散系.下列关于胶体的说法错误的是( )
| A、制备Fe(OH)3胶体的方法是在浓FeCl3溶液中加入大量浓NaOH溶液,并不断搅拌 |
| B、Fe(OH)3胶体中的胶体粒子大小在1~100nm之间 |
| C、可用丁达尔效应区分Fe(OH)3胶体和蔗糖溶液 |
| D、当光束通过有尘埃的空气或稀豆浆时都能观察到丁达尔效应 |
下列关于第①步的说法,错误的是( )
| A、Al起始反应的离子方程式为2Al+6H+=2Al3++3H2↑ |
| B、滤液I中一定含有Cu2+、Al3+;一定含有Fe2+和Fe3+中的一种或两种 |
| C、滤渣I的主要成分是Au与Pt,由此可以回收贵重的金属 |
| D、加入稀硫酸可以提高硝酸的利用率,使硝酸根离子完全反应 |

 与DMC1:1发生类似反应①的反应,请写出反应方程式
与DMC1:1发生类似反应①的反应,请写出反应方程式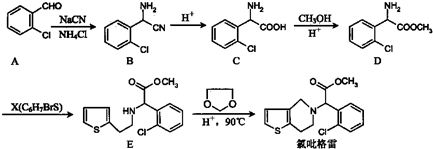
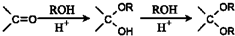
 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).