题目内容
下列关于碱金属的说法中,正确的是( )
| A、碱金属单质的密度都比水轻,投入水中都能浮在水面上 |
| B、碱金属单质都是还原剂,其还原性随着核电荷数的增大而增强 |
| C、碱金属单质的熔沸点一般随着原子的电子层数的增多而升高 |
| D、碱金属单质在氧气中燃烧,产物都是过氧化物 |
考点:碱金属的性质
专题:
分析:A.Rb和铯密度大于水;
B.同主族元素金属性从上到下依次增强;
C.根据影响金属晶体熔沸点高低的因素判断;
D.锂在氧气中燃烧生成氧化锂.
B.同主族元素金属性从上到下依次增强;
C.根据影响金属晶体熔沸点高低的因素判断;
D.锂在氧气中燃烧生成氧化锂.
解答:
解:A.Rb和铯密度大于水,沉在水底,故A错误;
B.同主族元素金属性从上到下依次增强,单质的还原性依次增强,故B正确;
C.原子半径Li<Na<K<Rb<Cs,晶体结构相似,则原子半径越大,金属键越弱,单质的熔沸点越低,故C错误;
D.锂在氧气中燃烧生成氧化锂,产物不是过氧化物,故D错误;
故选:B.
B.同主族元素金属性从上到下依次增强,单质的还原性依次增强,故B正确;
C.原子半径Li<Na<K<Rb<Cs,晶体结构相似,则原子半径越大,金属键越弱,单质的熔沸点越低,故C错误;
D.锂在氧气中燃烧生成氧化锂,产物不是过氧化物,故D错误;
故选:B.
点评:本题考查碱金属元素结构及单质性质的递变性,掌握元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各图示实验设计和操作合理的是( )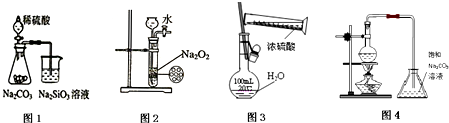

| A、图1 证明非金属性强弱:S>C>Si |
| B、图2 制备少量氧气 |
| C、图3 配制一定物质的量浓度的硫酸溶液 |
| D、图4 制备少量乙酸丁酯 |
完成下列实验所选择的装置或仪器(夹持装置部分已略去)正确的是( )
| A | B | C | D | |
| 实 验 | 分离Na2CO3溶液和CH3CH2OH | 除去Cl2中含有的少量HCl | 做Cl2对NaOH溶液的喷泉实验 | 制取少量氨气 |
| 装 置 或 仪 器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
将足量的NO2和一定量的SO2混合气体通入氯化钡中,产生的沉淀( )
| A、不可能是亚硫酸钡 |
| B、一定是亚硫酸钡 |
| C、一定是硫酸钡 |
| D、一定是亚硫酸钡和硫酸钡 |
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A、将HA加水稀释,溶液中所有粒子的浓度均减小 |
| B、等浓度的HA和NaOH溶液中水的电离程度相同 |
| C、图中X表示HA,Y表示H+,Z表示OH- |
| D、该混合溶液中:c(A-)+c(X)-c(Z)=0.1mol?L-1 |
用铂作电极电解某种溶液,通电一段时间后,溶液的pH变小,且在阳极得到0.56L气体,阴极得到1.12L气体(两种气体体积均在相同条件下测定).由此可知,该溶液可能是( )
| A、CuSO4溶液 |
| B、HBr溶液 |
| C、NaCl溶液 |
| D、硫酸溶液 |
放热反应CO(g)+H2O(g)?CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol?L-1,其平衡常数为K1.升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则( )
| A、K2和K1的单位均为mol?L-1 |
| B、K2>K1 |
| C、c2(CO)=c2(H2O) |
| D、c1(CO)>c2(CO) |
