题目内容
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解池:2Al+3O2![]() Al2O3+3H2
Al2O3+3H2
电解过程中,以下判断正确的是
| 电池 | 电解池 | |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e=Pb2++2H2O | 阳极:2Al+3H2O-6e=Al2O3+6H+ |
| D |
|
|
【解析】该题考查原电池和电解池的基本知识。A选项H+离子在原电池中移向PbO2电极,错误。B选项每消耗3molPb,根据电子守恒生成lmolAl2O3,错误。C选项在原电池的正极电极反应是生成PbSO4,错误。D选项在原电池中Pb电极的质量由于生成PbSO4,质量增加,在电解池中,Pb阴极,质量不变,正确。
答案:D

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目


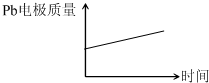
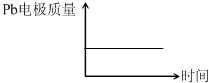



 Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
