题目内容
13.含有非极性键的离子化合物是( )| A. | NH4Cl | B. | NaOH | C. | Na2O2 | D. | MgCl2 |
分析 同种非金属元素之间易形成非极性键,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,含有离子键的化合物是离子化合物,据此分析解答.
解答 解:A.氯化铵中铵根离子和氯离子之间存在离子键,铵根离子中N-H原子之间存在极性键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故B错误;
C.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,为含有非极性键的离子化合物,故C正确;
D.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故D错误;
故选C.
点评 本题考查化学键、化合物判断,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,注意不能根据是否含有金属元素判断离子键,易错选项是D.

练习册系列答案
相关题目
3.青蒿酸是合成青蒿素的原料,可以由香草醛合成:
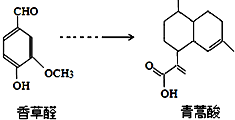
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 青蒿酸分子中含有4个手性碳原子 | |
| B. | 在一定条件,香草醛可与HCHO发生缩聚反应 | |
| C. | 两种物质分别和H2反应,最多消耗H24mol和3mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸 |
4.用下列实验装置和方法进行相应实验,能达到实验目的是( )


| A. | 用图甲所示方法检查装置的气密性 | |
| B. | 乙图装置可用于吸收HCl气体,并防止倒吸 | |
| C. | 大理石和稀硫酸反应制CO2时选用丙图装置 | |
| D. | 用丁图所示装置将溶液定容到100mL |
1.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收1mol SO2就会放出5.6LCO2 |
8.酸雨形成的主要原因是( )
| A. | 森林遇到乱砍滥伐,破坏了生态平衡 | |
| B. | 工业上大量燃烧含硫燃料 | |
| C. | 硫酸厂排出的大量气体 | |
| D. | 大气中CO2的含量增多 |
5.漂白粉在溶液中存在下列平衡:ClO-+H2O?HClO+OH-,下列措施能提高其漂白效率的是( )
| A. | 加H2O | B. | 通入CO2 | C. | 通入SO2 | D. | 加少量NaOH |
2.请写出除去下列杂质的化学方程式.
| 物质 | 杂质 | 化学方程式 | |
| ① | Na2CO3溶液 | NaHCO3 | NaOH+NaHCO3=H2O+Na2CO3 |
| ② | Mg粉 | Al 粉 | 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ |
| ③ | CO2 | SO2 | SO2+2NaHCO3═Na2SO3+H2O+2CO2 |
3.一澄清透明的溶液中,已知各离子的浓度相等,可能含有的阳离子有Na+、Fe2+、Ba2+、NH4+,可能含有的阴离子有Cl-、NO3-、CO32-、SO42-.向该混合溶液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变.下列叙述正确的是( )
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
