题目内容
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下22.4LNO2中分子数约为NA个 | |
| B. | 常温下,18g${\;}_{\;}^{18}$O2中含有个NA氧原子 | |
| C. | 31g白磷中含的共价键数为3NA | |
| D. | 25℃时pH=13的NaOH溶液中含有0.1NAOH- |
分析 A、根据分子数N=$\frac{V}{{V}_{m}}{N}_{A}$来计算;
B、${\;}_{\;}^{18}$O2由氧原子构成;
C、白磷分子中含有6个P-P共价键,白磷分子式为P4,据此进行计算含有共价键数目;
D、溶液体积不明确.
解答 解:A、标况下,22.4L气体中含有的分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}{N}_{A}$=NA个,故A正确;
B、${\;}_{\;}^{18}$O2由氧原子${\;}_{\;}^{18}$O构成,故18g${\;}_{\;}^{18}$O2中含有的${\;}_{\;}^{18}$O的物质的量n=$\frac{18g}{18g/mol}$=1mol,即NA个,故B正确;
C、白磷是正四面体型结构,分子中含有6个P-P共价键;31 g白磷(分子式为P4)的物质的量是0.25mol,所以分子中含有P-P共价键1.5mol,含有的共价键数目为1.5 NA,故C错误;
D、溶液体积不明确,故溶液中含有的氢氧根的个数无法计算,故D错误.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1. 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(l)在第②步中,将上述固体与浓盐酸混合的目的是将MnO2还原成Mn2+
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3;
假设二:全部为Mn(OH)2;
假设三:既有MnCO3又有Mn(OH)2
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成表中的内容.
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图.根据图中的数据判断假设三成立,理由是300℃以后,质量增加量为MnO氧化为MnO2 ,计算可得MnCO3质量为11.5(或MnO(OH)2的质量为10.5g),所以既有MnCO3又有Mn(OH)2.
 锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.
锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业.碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰.某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰.①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(l)在第②步中,将上述固体与浓盐酸混合的目的是将MnO2还原成Mn2+
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成.请写出加入NH4HCO3溶液时发生的离子反应方程式Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3;
假设二:全部为Mn(OH)2;
假设三:既有MnCO3又有Mn(OH)2
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成表中的内容.
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, 将沉淀充分暴露于空气中,观察颜色 | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,加入足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
2.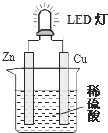 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
 LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
LED(Light Emitting Diode),发光二极管,是一种能够将电能转化为可见光的固态的半导体器件,它可以直接把电能转化为光能.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )| A. | 装置中存在“化学能→电能→光能”的转换 | |
| B. | 铜片上发生的反应为:2H++2e-=H2 | |
| C. | 如果将硫酸换成柠檬汁,导线中不会有电子流动 | |
| D. | 如果将锌片换成铁片,电路中的电流方向不变 |
6.因为下列各项的不同,造成反应热△H的大小也不同的是( )
| A. | 反应物和生成物的状态 | B. | 是否使用催化剂 | ||
| C. | 一步完成还是多步完成 | D. | 反应的快慢 |
16.下列对于实验I~IV的说法正确的是( )


| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡 | |
| B. | 实验Ⅱ:可比较氯、碳、硅三种元素的非金属性强弱 | |
| C. | 实验Ⅲ:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
3.某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是( )


| A. | 电极材料必须是金属材料 | |
| B. | 若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮 | |
| C. | 若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极 | |
| D. | 若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极 |
1.有15g A 物质与10.5g B物质恰好完全反应,生成7.2g C物质、1.8gD物质和0.3molE物质.则E的摩尔质量是( )
| A. | 111g•mol-1 | B. | 100g•mol-1 | C. | 27.5g•mol-1 | D. | 55g•mol-1 |
