题目内容
下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4.
①BF3 ②CH2═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4.
| A、①②③ | B、①⑤⑥ |
| C、②③④ | D、③⑤⑥ |
考点:原子轨道杂化方式及杂化类型判断,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=
×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.可用sp2杂化轨道来解释说明中心原子含有3个价层电子对,据此分析判断.
| 1 |
| 2 |
解答:
解:①BF3分子中价层电子对个数=3+
×(3-3×1)=3,中心原子杂化类型分别为sp2,故①正确;
②CH2═CH2 分子中碳原子价层电子对个数=3+
×(4-4×1)=3,每个碳原子杂化轨道数为3,所以采取sp2杂化,故②正确;
③苯分子中碳原子价层电子对个数=3+
×(4-4×1)=3,杂化轨道数为3,所以采取sp2杂化,故③正确;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+
×(4-4×1)=2,每个碳原子杂化轨道数为2,所以采取sp杂化,故④错误;
⑤NH3中N原子杂化轨道数为
×(5+3)=4,采取sp3杂化方式,故⑤错误;
⑥CH4中碳原子价层电子对个数=4+0=4,为sp3杂化,故⑥错误;
故选A.
| 1 |
| 2 |
②CH2═CH2 分子中碳原子价层电子对个数=3+
| 1 |
| 2 |
③苯分子中碳原子价层电子对个数=3+
| 1 |
| 2 |
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,碳原子价层电子对个数=2+
| 1 |
| 2 |
⑤NH3中N原子杂化轨道数为
| 1 |
| 2 |
⑥CH4中碳原子价层电子对个数=4+0=4,为sp3杂化,故⑥错误;
故选A.
点评:本题考查了原子杂化类型的判断,根据价层电子对互斥理论来分析解答,注意孤电子对个数=
×(a-xb)中各个字母的含义,题目难度中等.
| 1 |
| 2 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A、压强不变,充入氮气使容器体积增大 |
| B、将容器的体积缩小一半 |
| C、增加铁的量 |
| D、体积不变,充入氮气使容器压强增大 |
柠檬酸的结构简式如图,下列说法正确的是( )
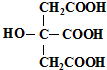
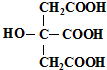
| A、柠檬酸中能发生酯化反应的官能团有2种 |
| B、1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C、1 mol柠檬酸与足量金属Na反应生成生成1.5mol H2 |
| D、柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |
金属钠在空气中放置,最终变为( )
| A、NaOH |
| B、Na2CO3 |
| C、NaHCO3 |
| D、Na2CO3?10H2O |
相同条件下,物质的量相等的两种气体,下列( )也一定相等.
| A、密度 | B、质量 |
| C、原子数 | D、分子数 |
下列离子方程式正确的是( )
A、用小苏打治疗胃酸过多:
| ||
B、用食醋除去水瓶中的水垢:
| ||
| C、漂白粉溶液中加入稀盐酸:H++ClO-=HClO | ||
| D、向澄清石灰水中通入过量的二氧化碳气体:Ca2++2OH-+CO2=CaCO3↓+H2O |
分析下表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是( )
①是己酸②是己醇 ③是戊酸甲酯 ④在稀硫酸中易变质⑤一定能与钠反应.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、②⑤ | B、①③④ |
| C、③④ | D、②③⑤ |
钠着火时可以用于灭火的是( )
| A、水 | B、砂 |
| C、干粉灭火器 | D、泡沫灭火器 |