题目内容
8. 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:(1)铁在元素周期表中的位置第四周期第ⅤⅢ族.
(2)k3[Fe(CN)6]溶液可用于检验Fe2+(填离子符号).CN-中碳原子杂化轨道类型为sp杂化,C、N、O三元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)?Fe(s)+xCO(g).已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有金属键.
(4)铜晶体铜碳原子的堆积方式如图1所示.
①基态铜原子的核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1.
②每个铜原子周围距离最近的铜原子数目12.
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图2所示(黑点代表铜原子).
①该晶体的化学式为CuCl.
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于共价(填“离子”、“共价”)化合物.
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm(只写计算式).
分析 (1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族;
(2)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,根据C原子价层电子对个数确定杂化方式;一般来说非金属性越强,第一电离能越大,但是因为p轨道半充满体系具有很强的稳定性,会有特例,如N的p轨道本来就是半充满的,O的p轨道失去一个电子才是半充满的,所以O比N容易失去电子;
(3)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;根据生成物判断形成的化学键;
(4)①铜为29号元素,据此写出基态铜原子的核外电子排布式;
②根据晶胞结构图可知,铜为面心立方堆积,据此判断每个铜原子周围距离最近的铜原子数目;
(5)根据价电子排布式判断出X原子为Cl原子;
①利用均摊法计算得出;
②根据电负性差值判断化合物类型;
③计算出一个晶胞中微粒数,利用化合物的摩尔质量和密度计算出晶胞边长,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$.
解答 解:(1)铁是26号元素,位于周期表中第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
(2)K3[Fe(CN)6]遇Fe2+,出现特殊的蓝色沉淀,可用于检验Fe2+,CN-中C原子价层电子对个数=1+$\frac{1}{2}$(4+1-1×3)=2,所以采取sp杂化;一般来说非金属性越强,第一电离能大,但是因为p轨道半充满体系具有很强的稳定性.N的p轨道本来就是半充满的.O的p轨道失去一个电子才是半充满的.所以C、N、O三元素的第一电离能由大到小的顺序为N>O>C,
故答案为:Fe2+;sp杂化;N>O>C;
(3)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,
故答案为:分子晶体;5;金属键;
(4)①铜为29号元素,基态铜原子的核外电子排布式为[Ar]3d104s1 或1s22s22p63s23p63d104s1,
故答案为:[Ar]3d104s1 或1s22s22p63s23p63d104s1;
②根据晶胞结构图可知,铜为面心立方堆积,所以每个铜原子周围距离最近的铜原子位于经过该原子的立方体的面的面心上,共有12个,
故答案为:12;
(5)根据价电子排布式判断出X原子为Cl原子;
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,
故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,
故答案为:共价;
③一个晶胞的摩尔质量为4×99.5g/mol,晶胞摩尔体积为$\frac{4×99.5}{ρ}$cm3,晶胞的边长为$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$,而体对角线为晶胞边长的$\sqrt{3}$倍,所以铜原子和M原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$×1010.
点评 本题考查较为全面,涉及到电子排布式、第一电离能、杂化类型的判断、配合物以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 化学能转化为电能 | B. | 电能转化为化学能 | ||
| C. | 化学能转化为热能 | D. | 化学能转化为光能 |
| A. | 铁和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 食盐水中滴加硝酸银溶液:Ag++Cl-═AgCl↓ | |
| D. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
| A. | 铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| B. | 向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 该反应的燃烧热为905KJ | |
| C. | 该反应为放热反应 | |
| D. | 该反应中每4molNH3(g)被氧化,放出905 kJ热量 |

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂B.
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液.
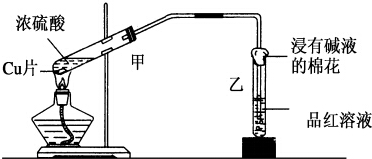 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验. 如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.
如图是一块用FeCl3溶液与Cu反应制作的印刷电路板,其制作原理可用下式表示:2FeCl3+Cu═CuCl2+2X.