题目内容
已知:CH3-CH=CH2+HBr→CH3CHBrCH3.
1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.

(1)A的化学式为 ,A的结构简式为 .
(2)上述反应中,①是 反应,②是 反应.(填反应类型)
(3)写出E、H物质的结构简式:E ; H .
(4)写出D→F反应的化学方程式 .
1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.

(1)A的化学式为
(2)上述反应中,①是
(3)写出E、H物质的结构简式:E
(4)写出D→F反应的化学方程式
考点:有机物的推断
专题:
分析:1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O,各物质的物质的量之比等于其分子数之比,再结合原子守恒知,A分子中含有8个C原子、8个H原子,其分子式为C8H8,A中不饱和度=
=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为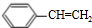 ,C为
,C为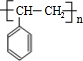 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为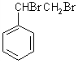 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为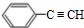 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故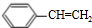 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为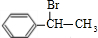 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为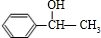 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为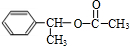 ,据此解答.
,据此解答.
| 8×2+2-8 |
| 2 |
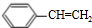 ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故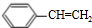 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为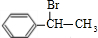 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为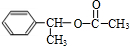 ,据此解答.
,据此解答.解答:
解:1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O,各物质的物质的量之比等于其分子数之比,再结合原子守恒知,A分子中含有8个C原子、8个H原子,其分子式为C8H8,A中不饱和度=
=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为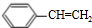 ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故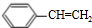 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为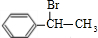 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为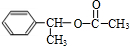 ,
,
(1)通过以上分析知,A的化学式为C8H8,A的结构简式为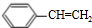 ,
,
故答案为:C8H8;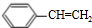 ;
;
(2)通过以上分析知,①是加成反应,②是消去反应,故答案为:加成;消去;
(3)通过以上分析知,E、H物质的结构简式分别为 、
、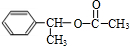 ,故答案为:
,故答案为: ;
;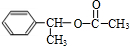 ;
;
(4)D→F是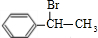 在氢氧化钠水溶液、加热条件下发生水解反应生成
在氢氧化钠水溶液、加热条件下发生水解反应生成 ,反应方程式为:
,反应方程式为: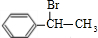 +NaOH
+NaOH
 +NaBr,
+NaBr,
故答案为: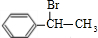 +NaOH
+NaOH
 +NaBr.
+NaBr.
| 8×2+2-8 |
| 2 |
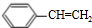 ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,则E为 ,E与溴发生加成反应生成
,E与溴发生加成反应生成 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故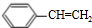 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为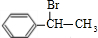 ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为 ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为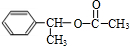 ,
,(1)通过以上分析知,A的化学式为C8H8,A的结构简式为
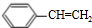 ,
,故答案为:C8H8;
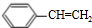 ;
;(2)通过以上分析知,①是加成反应,②是消去反应,故答案为:加成;消去;
(3)通过以上分析知,E、H物质的结构简式分别为
 、
、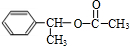 ,故答案为:
,故答案为: ;
;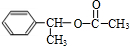 ;
;(4)D→F是
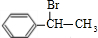 在氢氧化钠水溶液、加热条件下发生水解反应生成
在氢氧化钠水溶液、加热条件下发生水解反应生成 ,反应方程式为:
,反应方程式为: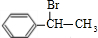 +NaOH
+NaOH| H2O |
| △ |
 +NaBr,
+NaBr,故答案为:
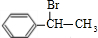 +NaOH
+NaOH| H2O |
| △ |
 +NaBr.
+NaBr.
点评:本题考查有机物推断,涉及烃、卤代烃、烯烃、醇、酯之间的转化,正确推断A结构是解本题关键,会根据其不饱和度进行推断结构,注意物质之间转化条件,条件不同导致产物不同.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列说法正确的是( )
| A、物质发生化学变化都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定相等 |
| D、在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
下列离子方程式书写正确的是( )
| A、硫酸铝溶液中滴加过量浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、乙酸钠溶液显碱性原因:CH3COO-+H2O=CH3COOH+OH- |
| C、氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O |
| D、漂白粉放置在空气中变质:ClO-+CO2+H2O=HClO+HCO3- |
甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同.下列判断正确的是( )
| A、含乙元素的化合物数目比含甲、丙元素的化合物数目多 |
| B、甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 |
| C、原子半径由大到小的顺序为丙>甲>乙 |
| D、乙元素的族序数比甲元素的族序数小 |
 锌电池用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等.
锌电池用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等. 亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯).亚硝酰氯的熔点为-64.5℃,沸点为-5.5℃,并且遇水蒸气分解为氮的氧化物和氯化氢.
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯).亚硝酰氯的熔点为-64.5℃,沸点为-5.5℃,并且遇水蒸气分解为氮的氧化物和氯化氢.

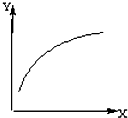 在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在密闭容器中加入A、B两种物质,在一定条件下反应:2A(s)+B(g)?2C(g) (△H<0).达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )