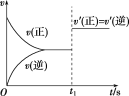
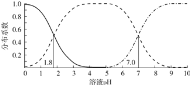
题目内容
【题目】下列说法正确的是
A.水的离子积![]() 只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.![]() 不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,能使溶液的pH减小,
晶体,能使溶液的pH减小, 的比值增大
的比值增大
D.室温下,![]() 的
的![]() ,
,![]() 的
的![]() ,
,![]() 溶液中的c
溶液中的c![]() 与
与![]() 中的
中的![]() 相等
相等
【答案】C
【解析】
A.水的离子积![]() 只与温度有关,但外加酸、碱抑制水的电离,水解的盐一定会影响水的电离程度,但不水解的盐如NaCl不影响水的电离,故A错误;
只与温度有关,但外加酸、碱抑制水的电离,水解的盐一定会影响水的电离程度,但不水解的盐如NaCl不影响水的电离,故A错误;
B.![]() 与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误;
与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,故B错误;
C.常温下,在![]() 的
的![]() 溶液中加入少量
溶液中加入少量![]() 晶体,溶解后铵根离子浓度增大,氨水的电离平衡逆向进行,氢氧根离子浓度减小,能使溶液的pH减小,电离平衡常数不变,所以
晶体,溶解后铵根离子浓度增大,氨水的电离平衡逆向进行,氢氧根离子浓度减小,能使溶液的pH减小,电离平衡常数不变,所以 的比值增大,故C正确;
的比值增大,故C正确;
D.室温下,醋酸溶液中![]() ,氨水溶液中
,氨水溶液中![]() ,两种溶液的浓度相对大小未知,所以无法判断醋酸溶液中氢离子浓度和氨水中氢氧根离子浓度的相对大小,故D错误。
,两种溶液的浓度相对大小未知,所以无法判断醋酸溶液中氢离子浓度和氨水中氢氧根离子浓度的相对大小,故D错误。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】(1)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水;已知:
N2H4 (g)+O2 (g)=N2(g)+2H2O (g) △H=-543kJ/mol
N2 (g)+2O2 (g)=2NO2 (g) △H=+67.7kJ/mol
H2 (g)+![]() O2 (g)=H2O (g) △H=-242kJ/mol
O2 (g)=H2O (g) △H=-242kJ/mol
![]() H2 (g)+
H2 (g)+![]() F2 (g)=HF (g) △H=-269kJ/mol
F2 (g)=HF (g) △H=-269kJ/mol
①肼和二氧化氮反应的热化学方程式为_______________________;
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟气反应的热化学方程式:_______________________
(2)某同学做浓度对化学反应速率的影响的实验时,将3支试管编号为①②③,并按下表中物质的量进行实验,记录下的时间数据是:16 s、28 s、33 s。请将3个数据填入下表的适当位置,并写出实验结论。
①将对应①、②、③的时间分别写出:(a)________,(b)______,(c)________。
②实验结论:___________。
③写出反应的化学方程式___________。
试管编号 | 加3%Na2S2O3 | 加H2O | 加H2SO4(1∶5) | 出现浑浊时间 |
① | 3 mL | 3 mL | 5滴 | (a) s |
② | 4 mL | 2 mL | 5滴 | (b) s |
③ | 5 mL | 1 mL | 5滴 | (c) s |
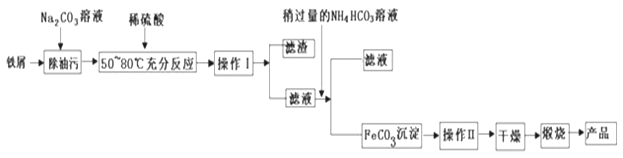
【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。