题目内容
18.(1)质量比为16:7:6的三种气体SO2、CO、NO,分子个数之比为5:5:4;氧原子个数之比为10:5:4.(2)在标准状况下,6.8g PH3与标准状况下3.36L CH4含有相同数目的H原子.
(3)某气体氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为64g/mol,R的相对原子质量为32.
(4)273K、1.01×105 Pa时气态单质X2的密度为1.25g•L-1,则X的相对原子质量为14.
(5)相同温度和压强条件下,一定体积的气态氢化物H2R的质量是等体积NH3的2倍,则R的相对原子质量为32.
分析 (1)根据n=$\frac{m}{M}$计算SO2、CO、NO的物质的量之比,分子数目之比等于其物质的量之比,结合分子式计算含有氧原子数目之比;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$=$\frac{V}{Vm}$结合PH3含有3个H,CH4含有4个H解答;
(3)根据n=$\frac{V}{Vm}$计算RO2的物质的量,再根据M=$\frac{m}{n}$计算其摩尔质量,进而计算R的相对原子质量;
(4)依据ρ标=$\frac{M}{Vm}$计算M,然后计算X的相对原子质量;
(5)相同状态下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,根据m=nM计算X的摩尔质量.
解答 解:(1)质量比为16:7:6的三种气体 SO2、CO、NO物质的量之比为$\frac{16g}{64g/mol}$:$\frac{7g}{28g/mol}$:$\frac{6g}{30g/mol}$=5:5:4,故三者分子数目之比为5:5:4,含有氧原子数目之比为5×2:5×1:4×1=10:5:4,
故答案为:5:5:4、10:5:4;
(2)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$=$\frac{V}{Vm}$要使二者含有氢原子数相等则满足:$\frac{6.8g}{34g/mol}$×3=$\frac{V}{22.4L/mol}$×4,解得V=3.36L,
故答案为:3.36;
(3)RO2的物质的量的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,其摩尔质量为$\frac{1.28g}{0.02mol}$=64g/mol,R的相对原子质量为64-32=32,
故答案为:64g/mol;32;
(4)273K、1.01×105 Pa时气态单质X2的密度为1.25g•L-1,则M=ρ标×22.4L/mol=1.25g•L-1×22.4L/mol=28g/mol;则X的相对原子质量为:28÷2=14;
故答案为:14;
(5)相同状态下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,根据m=nM知,相同物质的量时气体质量与摩尔质量成正比,相同状况下,一定体积的气态氢化物H2R的质量是等体积NH3的2倍,则H2R的摩尔质量是氨气的2倍,为34g/mol,则R摩尔质量=(34-2)g/mol=32g/mol,相对原子质量为32;
故答案为:32.
点评 本题考查物质的量的有关计算,为高频考点,明确相同条件下不同气体质量与摩尔质量关系是解本题关键,熟练掌握并灵活运用物质的量有关公式,题目难度不大.

| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙烯与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素互为同分异构体,二者水解的最终产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 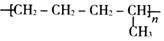 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 |
| A. | 该溶液中Cu2+、NH4+、SO42-、Cl-可以大量共存 | |
| B. | 与硝酸酸化的AgNO3溶液反应有淡黄色沉淀生成并放出气体 | |
| C. | 向含有1 mol FeBr2的溶液中通入33.6 L Cl2,反应转移电子数目为3NA | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | AlCl3 |
| A. | 丁达尔效应 | B. | 明矾的净水作用 | ||
| C. | CuSO4溶液显蓝色 | D. | 分散质粒子直径1~100nm |