题目内容
6.加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g.下列有关叙述中不正确的是( )| A. | 原混合物中CuO和Fe2O3的物质的量的比为1:1 | |
| B. | 参加反应的CO的质量为11.2g | |
| C. | 原混合物中Fe元素的质量为5.6g | |
| D. | 原混合物中CuO的质量分数约为33.3% |
分析 反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g为碳酸钙质量,即0.4mol,所以二氧化碳为0.4mol.根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol,设CuO、Fe2O3的物质的量分别为x、y,列方程计算x、y的值,结合选项具体判断.
解答 解:反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40g为碳酸钙质量,碳酸钙的物质的量为:$\frac{40g}{100g/mol}$=0.4mol,根据碳原子守恒,所以反应后所得CO2的物质的量为为0.4mol,
一个CO获得1个氧原子生成CO2,根据氧原子守恒,可知24gCuO、Fe2O3的混合物中氧原子的物质的量为0.4mol,
设CuO、Fe2O3的物质的量分别为x、y,则:x+3y=0.4mol、x×80g/mol+y×160g/mol=24g,解得:x=0.1、y=0.1,
A.由上述计算可知,原混合物中CuO与Fe2O3物质的量比为0.1mol:0.1mol=1:1,故A正确;
B.反应过程中参加反应的CO质量为0.4mol×28g/mol=11.2g,故B正确;
C.原混合物中铁元素的物质的量为0.2mol,质量为:56g/mol×0.2mol=11.2g,故C错误;
D、由上述计算可知,原混合物中CuO的物质的量为0.1mol,质量为:80g/mol×0.1mol=8g,原混合物中CuO的质量数为:$\frac{8g}{24.0g}$×100%≈33.3%,故D正确;
故选C.
点评 本题考查根据方程式及混合的有关计算,题目难度中等,关键根据一个CO获得1个氧原子生成CO2判断混合物中氧原子的物质的量为0.4mol,结合守恒进行计算,注意守恒思想在混合计算中的运用.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 金刚石>晶体硅>碳化硅 | B. | K>Na | ||
| C. | HCHO<CH3OH | D. | NaF<NaCl<NaBr |
| A. | C2H4 | B. | C2H5 COOH | C. | CH3CHO | D. | CH3CO CH3 |
| A. | 剧烈燃烧 | B. | 发出耀眼白光 | C. | 熔化的铝滴落 | D. | 失去金属光泽 |
| A. | C2H2 C2H4 | B. | CH4 C3H6 | C. | CH4 C4H8 | D. | C2H6 C3H8 |

| A. | 加成反应 | B. | 取代反应 | C. | 氧化反应 | D. | 化合反应 |
| A. | 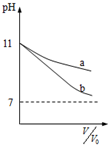 图可表示体积均为V0L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水 | |
| B. | 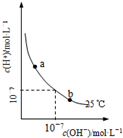 图可表示水溶液中H+与OH-的浓度变化曲线,则升高温度可实现a→b | |
| C. | 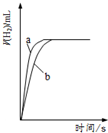 图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与0.003gZn反应,则a表示盐酸 | |
| D. | 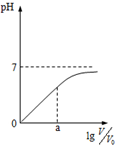 图可表示体积为V0L1 mol•L-1盐酸用水稀释至VL情况,则0~a范围内:pH=lg$\frac{V}{{V}_{0}}$ |
| A. | 绝大多数金属的冶炼主要依据氧化还原反应原理 | |
| B. | 工业上可利用铝热反应炼铁 | |
| C. | 金属铝的冶炼可采取电解熔融氯化铝的方法 | |
| D. | 金属冶炼常会消耗许多能量,也易造成环境污染 |
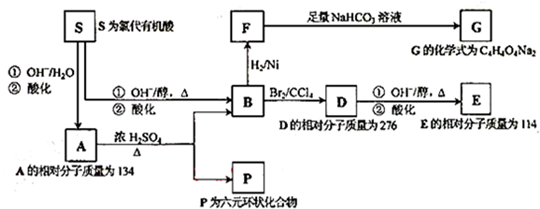
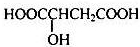 、P:
、P: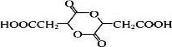 、E:HOOCC≡CCOOH、S:
、E:HOOCC≡CCOOH、S: .
. .
.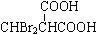
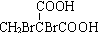 .
.