题目内容
【题目】下列离子方程式书写正确的是
A.碳酸钙溶于过量的乙酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.氟气与水反应:F2+H2O=H++F-+HFO
C.溴化亚铁溶液中通人少量氯气:2Fe2++C12=2Fe3++2Cl-
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
【答案】C
【解析】
A.乙酸在离子反应中保留化学式;
B.反应生成HF和氧气;
C.还原性亚铁离子大于溴离子,少量氯气只氧化亚铁离子;
D.生成胶体,不是沉淀。
A.碳酸钙溶于过量的乙酸的离子反应为CaCO3+2CH3COOH=Ca2++CO2↑+H2O+CH3COO-,故A错误;
B.氟气与水反应为2F2+2H2O=4HF+O2,故B错误;
C.溴化亚铁溶液中通人少量氯气的离子反应为2Fe2++C12=2Fe3++2Cl-,所以C选项是正确的;
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的离子反应为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故D错误;
Fe(OH)3(胶体)+3H+,故D错误;
综上所述,本题正确选项C。

 新思维假期作业寒假吉林大学出版社系列答案
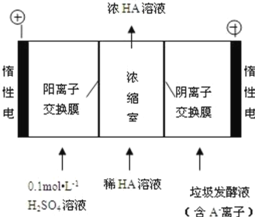
新思维假期作业寒假吉林大学出版社系列答案【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____molL﹣1,
(4)①0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。