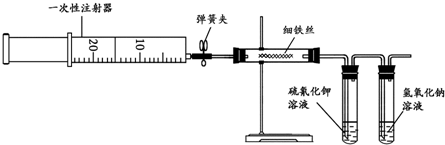
题目内容
某研究性学习小组用如图装置进行SO2与FeCl3溶液反应的相关实验.(夹持装置已略去)
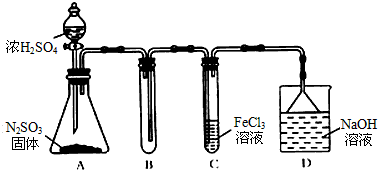
(1)通入足量SO2时C装置中观察到的现象为 .
(2)根据以上现象,该小组同学认为SO2与Fe3+反应生成SO42-和Fe2+.
①写出SO2与Fe3+反应的离子方程式: ;
②请设计实验方案检验C试管中生成的Fe2+: ;
③该小组向C装置反应后的溶液中加入稀硝酸酸化的BaCl2溶液,出现白色沉淀,证明反应生成了SO42-,该做法 (填“合理”或“不合理”),理由是 .
(3)D装置中倒置漏斗的作用是 .
(4)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂是 (填字母).
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaOH溶液.

(1)通入足量SO2时C装置中观察到的现象为
(2)根据以上现象,该小组同学认为SO2与Fe3+反应生成SO42-和Fe2+.
①写出SO2与Fe3+反应的离子方程式:
②请设计实验方案检验C试管中生成的Fe2+:
③该小组向C装置反应后的溶液中加入稀硝酸酸化的BaCl2溶液,出现白色沉淀,证明反应生成了SO42-,该做法
(3)D装置中倒置漏斗的作用是
(4)为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂是
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaOH溶液.
考点:性质实验方案的设计
专题:实验设计题
分析:(1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性;
(3)倒置漏斗可防止NaOH溶液倒吸;
(4)验证SO2具有还原性,代替氯化铁溶液的物质必须具有氧化性,且反应中有明显现象,据此进行解答.
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子;
②检验有Fe2+生成,利用KSCN和氯水,先不变红,后变红分析;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性;
(3)倒置漏斗可防止NaOH溶液倒吸;
(4)验证SO2具有还原性,代替氯化铁溶液的物质必须具有氧化性,且反应中有明显现象,据此进行解答.
解答:
解:(1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色,
故答案为:溶液由棕黄色变为浅绿色;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,
故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:不合理;硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,
故答案为:使气体充分吸收,防止溶液倒吸;
(4)a.浓H2SO4:浓硫酸不与二氧化硫反应,无法检验二氧化硫具有还原性,故a错误;
b.酸性KMnO4溶液:酸性高锰酸钾具有强氧化性,二氧化硫能够与酸性高锰酸钾发生氧化还原反应,导致高锰酸钾溶液褪色,从而证明二氧化硫具有还原性,所以可用酸性高锰酸钾溶液代替氯化铁溶液,故b正确;
c.碘水能够与二氧化硫发生氧化还原反应,导致碘水褪色,所以可用碘水代替氯化铁溶液,故c正确;
d.NaOH溶液与二氧化硫的反应不属于氧化还原反应,且反应中没有明显现象,无法替代氯化铁溶液验证二氧化硫具有还原性,故d错误;
故答案为:bc.
故答案为:溶液由棕黄色变为浅绿色;
(2)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+,
故答案为:2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验有Fe2+生成的实验方法为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红,
故答案为:取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理,
故答案为:不合理;硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸,
故答案为:使气体充分吸收,防止溶液倒吸;
(4)a.浓H2SO4:浓硫酸不与二氧化硫反应,无法检验二氧化硫具有还原性,故a错误;
b.酸性KMnO4溶液:酸性高锰酸钾具有强氧化性,二氧化硫能够与酸性高锰酸钾发生氧化还原反应,导致高锰酸钾溶液褪色,从而证明二氧化硫具有还原性,所以可用酸性高锰酸钾溶液代替氯化铁溶液,故b正确;
c.碘水能够与二氧化硫发生氧化还原反应,导致碘水褪色,所以可用碘水代替氯化铁溶液,故c正确;
d.NaOH溶液与二氧化硫的反应不属于氧化还原反应,且反应中没有明显现象,无法替代氯化铁溶液验证二氧化硫具有还原性,故d错误;
故答案为:bc.
点评:本题考查性质实验方案的设计及实验装置综合,为高频考点,题目难度中等,把握装置中发生的反应及氧化还原反应原理的应用为解答的关键,侧重分析与实验能力的考查.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列说法正确的是( )
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
下列化学用语正确的是( )
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: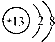 |
已知N元素最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
| A、NH3 |
| B、N2 |
| C、NO2 |
| D、HNO3 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |