题目内容
1. 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物 名称 | 密度(g/mL ) | 熔 点(℃) | 沸 点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)在该实验中,三口烧瓶的容积最适合的是A(填入正确选项前的字母).
A.50mL B.150mL C.250mL D.500mL
(3)本实验中容易产生烃类化合物的化学反应方程式为:HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O.
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(5)有机层粗产物依次用12mL水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液溶液洗涤的目的是除去产品中的硫酸;用氯化钙溶液洗涤的目的是除去少量的氢氧化钠,且能减少产物的损失.
(6)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(7)本实验所得到的正丁醚产率为35.34%.
分析 (1)根据逆流时冷凝效果好判断进水口;
(2)三口烧瓶的中所加入的液体为13.5mL)正丁醇、2.5mL浓硫酸,共约为16mL左右,三口烧瓶中液体加热时一般液体体积不超过三分之二,据此选择烧瓶的规格;
(3)正丁醇在浓硫酸加热的条件下容易脱水生成1-丁烯;
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,由于正丁醚的密度小于水,所以得到有机层在上层,要先将水层从分液漏斗下口放出,再将上层液体从上口倒出;
(5)有机层粗产物中有少量的硫酸,可以用氢氧化钠除去,正丁醚微溶于饱和氯化钙溶液,所以可以用饱和氯化钙溶液洗涤除去有机物中少量的氢氧化钠;
(6)洗涤完成后,加入无水氯化钙干燥,通过过滤除去无水氯化钙,再通过蒸馏可得丁醚;
(7)10.9g(相当13.5mL)正丁醇的物质的量为0.147mol,根据反应2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$C4H9OC4H9+H2O,生成的丁醚的物质的量为0.074mol,计算出理论产量,正丁醚产率=$\frac{实际产量}{理论产量}$×100%;
解答 解:(1)根据逆流时冷凝效果好,所以进水口为2,
故答案为:2;
(2)三口烧瓶的中所加入的液体为13.5mL)正丁醇、2.5mL浓硫酸,共约为16mL左右,三口烧瓶中液体加热时一般液体体积不超过三分之二,选择烧瓶的规格为50mL,
故选A;
(3)正丁醇在浓硫酸加热的条件下容易脱水生成1-丁烯,反应方程式HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O,
故答案为:HOCH2CHBrCH2CH3 $→_{△}^{浓H_{2}SO_{4}}$CH2=CHCH2CH3+H2O;
(4)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,由于正丁醚的密度小于水,所以得到有机层在上层,要先将水层从分液漏斗下口放出,再将上层液体从上口倒出,操作为将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出,
故答案为:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁留下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出;
(5)有机层粗产物中有少量的硫酸,可以用氢氧化钠除去产品中的硫酸,正丁醚微溶于饱和氯化钙溶液,所以可以用饱和氯化钙溶液洗涤除去有机物中少量的氢氧化钠,且能减少产物的损失,
故答案为:除去产品中的硫酸;除去少量的氢氧化钠,且能减少产物的损失;
(6)洗涤完成后,过滤除去无水氯化钙,再通过蒸馏可得丁醚,所以操作顺序是cba,
故答案为:cba;
(7)10.9g(相当13.5mL)正丁醇的物质的量为0.147mol,根据反应2CH3CH2CH2CH2OH$→_{135℃}^{浓硫酸}$C4H9OC4H9+H2O,生成的丁醚的物质的量为0.074mol,丁醚的理论产量为130×0.074g=9.62g,所以正丁醚产率=$\frac{实际产量}{理论产量}$×100%=$\frac{3.4g}{9.62g}$×100%=35.34%,
故答案为:35.34%.
点评 本题考查实验的基本操作,混合物的分离操作,重点考查分液、蒸馏操作,有关物质的量基本计算和产率的计算等,关注基础考查,中等难度.

| A. | ①③④ | B. | ②④ | C. | ③④ | D. | ①②③ |
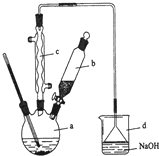 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
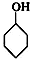
(1)写出实验室合成溴苯的化学反应方程式:
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
 ⑥
⑥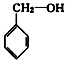 ⑦
⑦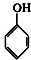
 Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
Cu2S是火法炼铜的重要原料之一,下面是由Cu2S冶炼铜及制取CuSO4•5H2O的流程图:
 阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:
阿司匹林可由水杨酸与乙酸酐作用制得.其制备原理如下:

 ;
;