��Ŀ����
����Ŀ��H2S ��һ�ִ�����Ⱦ���ҵ�ϲ�ȡ���ַ������������ŷš�
(1)��ҵ�Ͽɲ�ȡ������H2S ��������H2S ���ŷš�������H2S ��ԭ��Ϊ:H2S + Fe2(SO4)3= S��+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
�Իش���������:
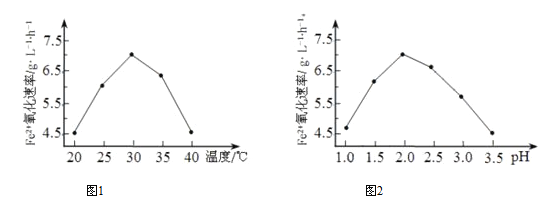
����˾�����ʱ��FeSO4����������������ʱ5.0��105�����þ���������_________��
������ͼ1��ͼ2 �ж�ʹ����˾����������Ϊ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����____________��
(2) �ʻ���(COS) ����ʯ����ҵ�����������DZ���У���������������Ʊ�����֮һ��H2S ��COS �ڸ����·�����Ӧ: H2S(g)+CO2(g)![]() COS(g)+H2O(g) ��610K ʱ����0.40mol H2S ��0.10molCO2����2.5 L �Ŀո�ƿ�У�H2S��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
COS(g)+H2O(g) ��610K ʱ����0.40mol H2S ��0.10molCO2����2.5 L �Ŀո�ƿ�У�H2S��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
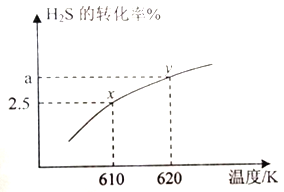
������˵���ܱ�����Ӧ�Ѵ�ƽ��״̬����__________��
A.H2S ��CO2�����ʵ���֮�ȱ��ֲ��� B.���������ܶȱ��ֲ���
C.��������ƽ����Է����������ٱ仯D.v��(H2S)=V��(COS)
���÷�Ӧ����H______0.(����>����<������=��)��x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��K=_____(������λ��Ч����)��
����620K�ظ����飬��ƽ���ˮ�����ʵ�������Ϊ0.030.��H2S ��ת����a=_____%��
���𰸡� ���ͷ�Ӧ��ܣ����������� 30����pH=2.0 �����ʱ��ԣ�����˾�ʧȥ���ԣ� AD �� 2.8��10�C3����0.0028�� 3.75
����������1���ٸ�����˾�����ʱ��FeSO4������������Զ������ʱ�����ʿ�֪����˾��Ĵ��ڽ����˷�Ӧ�Ļ�ܣ�������������ͼ1��֪��30�������������������ͼ2��֪��pH=2.0ʱ���������������ʹ����˾����������Ϊ��30�桢pH=2.0������Ӧ�¶ȹ��ߣ���˾������ʱ���ʧȥ�������ԣ����Է�Ӧ�����½���
��2����A���ʼ0.40molH2S��0.10molCO2����ո�ƿ�У��ɻ�ѧ����ʽ�ɵã�H2S��CO2��1��1�����ʵ���֮�ȷ�Ӧ������ֻҪ��ƽ�⣬H2S��CO2�����ʵ���֮�Ⱦͻ�ϱ仯����H2S��CO2�����ʵ���֮�ȱ��ֲ���ʱ˵���Ѿ��ﵽ��ѧƽ��״̬��A��ȷ��B����������غ㶨�ɣ�����������������䣬�ݻ����䣬���Ի��������ܶ�ʼ�ձ��ֲ��䣬���ܸ����ܶ��ж��Ƿ�ﵽƽ��״̬����B����C��÷�Ӧ�����������䡢���������䣬����ƽ����Է�������ʼ�ղ��䣬���ܸ���ƽ����Է��������ж��Ƿ�ﵽƽ��״̬����C����D�v��(H2S)=v��(COS)������Ϊv��(H2S)=v��(COS)����v��(H2S)=v��(H2S)�����Ѵﵽ��ѧƽ��״̬��D��ȷ�����ϣ�ѡAD������ͼ�ɵã��¶�����H2S��ת��������˵�����»�ѧƽ�������ƶ���������H>0��x��H2S��ת����Ϊ2.5%����Ӧ������Ϊ��0.40mol��2.5%=0.01mol���ɻ�ѧ����ʽ����ʼ���ʵ���������ʽ��

����K=![]() =
= ��2.8��10�C3����0.0028��(������λ��Ч����)��
��2.8��10�C3����0.0028��(������λ��Ч����)��
�۸÷�Ӧǰ���������ʵ������䣬��620K�ظ����飬��ƽ���ˮ�����ʵ�������Ϊ0.030����ˮ�����ʵ���Ϊ��(0.40mol+0.10mol)��0.030=0.015mol�����Է�Ӧ��H2SΪ0.015mol����H2S��ת����a=0.015mol��0.40mol��100%=3.75%��

����Ŀ���Ķ�������������Ԫ�ص������Ϣ��
Ԫ�ش��� | �����Ϣ |
A | A�ĵ���������ˮ���ҷ�Ӧ���õ�ǿ������Һ |
B | B��ԭ�����������������ڲ������������ |
C | �ڵ�3����Ԫ���У�C�ļ����Ӱ뾶����С |
D | A��B��D��ɵ�36���ӵĻ�����X�Ǽ�������������Ҫ�ɷ� |
E | �����л����ж�����EԪ�� |
��ش�
��1��д��E��Ԫ�����ڱ��е�λ�ã���C�ļ����ӵĽṹʾ��ͼ�� ��
��2��X�Ļ�ѧʽΪ ��
��3��A,B,C����Ԫ�صļ����ӵİ뾶�ɴ�С��˳��Ϊ�������ӷ��ű�ʾ����
��4��A,B��Ԫ����ɵĻ�����A2B2����������ӡ����ۡ��������
��5��CԪ���γɵĵ�������A������������Ӧ��ˮ���ﷴӦ�������ӷ���ʽΪ ��

