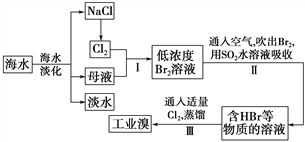
题目内容
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂。请回答下列问题:
(1)基态Ni原子价层电子的轨道表达式为__________________。
(2)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(3)![]() 因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与
因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与![]() 的结构密切相关,
的结构密切相关,![]() 的立体构型为________,P、O、S的电负性从大到小的顺序为_____,
的立体构型为________,P、O、S的电负性从大到小的顺序为_____,![]() 过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
A. B.
B.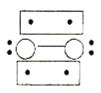 C.
C.![]() D.
D.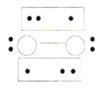
(4)![]() 易与
易与![]() 结合形成
结合形成![]() ,
,![]() 与
与![]() 间的化学键类型为________,若将配离子
间的化学键类型为________,若将配离子![]() 中的2个
中的2个![]() 换为
换为![]() ,2种结构,则
,2种结构,则![]() 是否为
是否为![]() 杂化________(填“是”或“否”),理由为_________________。
杂化________(填“是”或“否”),理由为_________________。
(5)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm。
的结构为体心立方堆积,晶胞参数为apm。![]() 中锰的原子半径为________pm。已知阿伏加德罗常数的值为
中锰的原子半径为________pm。已知阿伏加德罗常数的值为![]() ,
,![]() 的理论密度
的理论密度![]() ________
________![]() 。(列出计算式)
。(列出计算式)
【答案】 光谱分析 正四面体
光谱分析 正四面体 ![]() D 配位键 否 若是
D 配位键 否 若是![]() 杂化,
杂化,![]() 的空间构型为正四面体形,将配离子
的空间构型为正四面体形,将配离子![]() 中的2个
中的2个![]() 换为
换为![]() ,则只有1种结构
,则只有1种结构 ![]()
![]()
【解析】
(1)Ni的原子序数为28,电子排布式为1S22S22P63S23P63d84s2或[Ar]3d84s2,价电子排布式为3d84s2;
(2)用光谱仪器摄取各种元素的电子的吸收光谱或发射光谱总称原子光谱,不同元素原子的吸收光谱或发射光谱不同,所以可以利用原子光谱上的特征谱线来鉴定元素;
(3)PO43-中P原子的价层电子对数为4,孤对电子数为0;元素的非金属性越强,电负性越大;只有D的化学键中有3电子,存在单电子;
(4)[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为配位键;配离子[Cu(NH3)4]2+具有对称的空间构型,可能为平面正方形或正四面体形;
(5)δ-Mn的结构为体心立方堆积,所以晶胞中体对角线上的三个锰原子是相切的,依据分摊法计算可得。
(1)Ni的原子序数为28,电子排布式为1S22S22P63S23P63d84s2或[Ar]3d84s2,价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)用光谱仪器摄取各种元素的电子的吸收光谱或发射光谱总称原子光谱,不同元素原子的吸收光谱或发射光谱不同,所以可以利用原子光谱上的特征谱线来鉴定元素,则铜的焰色反应呈绿色称为光谱分析,故答案为:光谱分析;
(3)PO43-的中心原子为P,P原子的价层电子对数为![]() ,孤对电子数为0,则杂化类型为sp3杂化;元素的非金属性越强,电负性越大,三种元素中非金属性大小顺序为O>S>P,则电负性从大到小的顺序为O>S>P;结合信息可知,O2因具有单电子而成为顺磁性分子,从示意图可知,只有D的化学键中有3电子,存在单电子,则D最有可能代表O2分子结构,故答案为:sp3;O>S>P;D;
,孤对电子数为0,则杂化类型为sp3杂化;元素的非金属性越强,电负性越大,三种元素中非金属性大小顺序为O>S>P,则电负性从大到小的顺序为O>S>P;结合信息可知,O2因具有单电子而成为顺磁性分子,从示意图可知,只有D的化学键中有3电子,存在单电子,则D最有可能代表O2分子结构,故答案为:sp3;O>S>P;D;
(4)[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为配位键;配离子[Cu(NH3)4]2+具有对称的空间构型,可能为平面正方形或正四面体形,如为正四面体形,将配离子中的2个NH3换为CN—,只有1种结构,所以应为平面正方形,则Cu2+为sp2杂化,不是sp3杂化,故答案为:配位键;否;若是![]() 杂化,[Cu(NH3)4]2+的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN—,则只有1种结构;
杂化,[Cu(NH3)4]2+的空间构型为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN—,则只有1种结构;
(5)δ-Mn的结构为体心立方堆积,所以晶胞中体对角线上的三个锰原子是相切的,设锰原子半径为r,则有(4r)2=3a2,解得r=![]() pm;体心立方堆积中锰原子的个数为
pm;体心立方堆积中锰原子的个数为![]() +1=2,所以密度
+1=2,所以密度![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。