题目内容
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
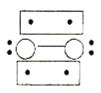
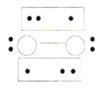
A.0.5 mol雄黄(As4S4)(结构如图:![]() )含有NA个S—S键
)含有NA个S—S键
B.1 mol CO和N2混合气体中含有的质子数为14NA
C.标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为0.6NA
【答案】B
【解析】
A. As原子最外层有5个电子,能够形成3个共价键,而S原子最外层有6个电子,只能形成2个共价键,根据图示可知,白球表示S原子,黑球表示As原子,雄黄分子中不存在S—S键,A错误;
B. 1 molCO的质子数为14NA,1 mol N2的质子数也为14NA,1 mol CO和N2混合气体无论任何比例,质子数均为14NA,B正确;
C. 标况下,二氯甲烷为液体,不能使用气体摩尔体积,C错误;
D. 16.8 g铁的物质的量为 0.3 mol,而铁与水蒸气反应后生成四氧化三铁,0.3 mol 铁失去0.8 mol 电子,即0.8NA个,D错误。
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】砷(![]() )元素广泛的存在于自然界,在周期表中的位置如表。
)元素广泛的存在于自然界,在周期表中的位置如表。
|
| |
|
| |
|
|
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,
)晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,![]() 的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐(![]() )在碱性条件下与碘单质反应生成砷酸盐(
)在碱性条件下与碘单质反应生成砷酸盐(![]() ),完成反应的离子方程式: ____
),完成反应的离子方程式: ____![]() +I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐(![]() )的废水转化为粗
)的废水转化为粗![]() 的工业流程如下:
的工业流程如下:
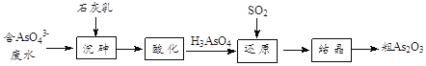
①写出还原过程中砷酸![]() 转化为亚砷酸
转化为亚砷酸![]() 的化学方程式: ___________
的化学方程式: ___________
②“沉砷”是将![]() 转化为
转化为![]() 沉淀,主要反应有:
沉淀,主要反应有:
i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q
Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。