题目内容
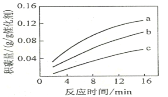
【题目】镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2 mol·L-1的NaOH 溶液。若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示。请回答下列问题:

(1)当V1=160mL时,则金属粉末中n(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为_____________________________________________________。
(3))若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4 mol·L-1的硫酸溶解此混合物后,再加入840mL 2 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
【答案】0.08 Al(OH)3+OH=AlO2+2H2O 0.6a<1
【解析】
(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明盐酸有剩余,滴加的NaOH用于中和剩余盐酸,V1=160mL时,剩余的HCl与滴加的NaOH恰好完全反应,溶液是MgCl2、AlCl3和NaCl混合液,根据镁原子、铝原子、氯离子、钠离子守恒,列方程求算n(Al);
(2)V2~V3段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(3)硫酸的物质的量等于HCl的物质的量,故硫酸有剩余,反应后的混合溶液再加入840mL2molL1的NaOH溶液,所得沉淀中无Al(OH)3,Al3+转化为AlO2,溶质为硫酸钠Na2SO4、NaAlO2,由于为金属混合物,则a<1,根据钠离子守恒:n(NaOH)2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用a表示出n(NaAlO2),据此确定a的取值范围。
(1)当V1=160mL时,此时溶液是MgCl2、AlCl3和NaCl的混合液,由Na+离子守恒可知:n(NaCl)=n(Na+)=n(NaOH)=0.16L×2mol/L=0.32mol,200mL4molL1的盐酸溶液中含有HCl的物质的量为:4mol/L×0.2L=0.8mol,设Mg为xmol,Al为ymol,则x+y=0.2,根据Cl离子守恒有:2x+3y+0.32=0.8,联立方程解得:x=0.12、y=0.08;
(2)V2~V3段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH=AlO2+2H2O;
(3)由于为金属混合物,则a<1,Al的物质的量为:0.2×(1a)mol,硫酸的物质的量等于HCl的物质的量,故硫酸有剩余,反应后的混合溶液再加入840mL2molL1的NaOH溶液,所得沉淀中无Al(OH)3,Al3+转化为AlO2,溶质为硫酸钠Na2SO4、NaAlO2,根据铝元素守恒可知:n(NaAlO2)=0.2×(1a)mol,根据钠离子守恒:n(NaOH)2n(Na2SO4)+n(NaAlO2),即:0.84×22×0.2×4+0.2×(1a),解得:a0.6,所以a的取值范围为:故0.6≤a<1。

【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A. 高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
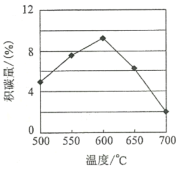
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·![]() (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。