题目内容
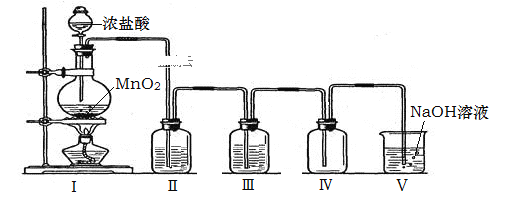
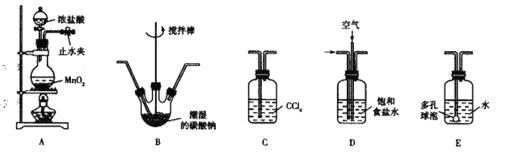
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置
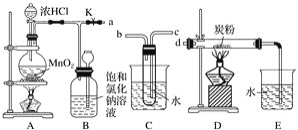
(1)①请写出装置A中发生反应的化学方程式______________________________________
②实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度_______。
③标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为________mol。
(2)要将C装置接入B和D之间,正确的接法是:a→________→________→d 。
(3)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_______________________________。
(4) D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是______________________________,B的作用是________________________
(5)A、B、C、D、E装置中有一处需要改进,请画出改进后的装置图 ________________________。
【答案】4H++2Cl﹣+MnO2![]() Cl2↑+Mn2++2H2O 11.9 mol/L 0.4 c b 2Cl2+C+2H2O(g)
Cl2↑+Mn2++2H2O 11.9 mol/L 0.4 c b 2Cl2+C+2H2O(g)![]() 4HCl+CO2 浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气 瓶中气体颜色加深且液面下降,长颈漏斗内液面上升 贮存少量氯气,避免氯气对环境造成污染 D中反应生成的HCl气体极易溶于水,易发生倒吸,改进后的装置图为
4HCl+CO2 浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气 瓶中气体颜色加深且液面下降,长颈漏斗内液面上升 贮存少量氯气,避免氯气对环境造成污染 D中反应生成的HCl气体极易溶于水,易发生倒吸,改进后的装置图为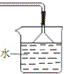
【解析】
(1)①A中是浓盐酸和二氧化锰发生氧化还原反应生成氯气的反应;
②实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸,该浓盐酸的物质的量浓度c=![]() ;
;
③利用化学方程式定量关系计算电子转移;
(2)气体通过盛有水的试管时应长进短出,否则不能通过C装置;
(3) 根据反应物和生成物,结合质量守恒定律书写化学方程式;利用浓硫酸溶于水放热的性质分析;
(4) B能贮存气体;
(5) HCl极易溶于水,易产生倒吸现象。
(1)①A中使浓盐酸和二氧化锰发生氧化还原反应生成氯气的反应,反应的离子方程式为:4H++2Cl﹣+MnO2![]() Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
②实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度=![]() =11.9mol/L;
=11.9mol/L;
③标准状况下,上述反应每生成4.48L氯气,物质的量=![]() =0.2mol,化学方程式中MnO2+4HCl(浓)
=0.2mol,化学方程式中MnO2+4HCl(浓)![]() MnC12+Cl2↑+2H2O;每生成1mol氯气,电子转移2mol,则生成0.2mol氯气转移电子的物质的量为0.4mol;
MnC12+Cl2↑+2H2O;每生成1mol氯气,电子转移2mol,则生成0.2mol氯气转移电子的物质的量为0.4mol;
(2) 由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,连接顺序为:acbd;
(3)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)![]() 4HCl+CO2中,C为提供水蒸气的装置,则加入浓硫酸,利用浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气;
4HCl+CO2中,C为提供水蒸气的装置,则加入浓硫酸,利用浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气;
(4) 关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中气体颜色加深且液面下降,长颈漏斗内液面上升;氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染;
(5)反应2Cl2+C+2H2O(g)![]() 4HCl+CO2中有HCl生成,需要尾气吸收,由于HCl极易溶于水,易产生倒吸现象,应用倒置的漏斗,改进后的装置图可以为:
4HCl+CO2中有HCl生成,需要尾气吸收,由于HCl极易溶于水,易产生倒吸现象,应用倒置的漏斗,改进后的装置图可以为: 。
。

【题目】现有部分短周期元素的性质或原子结构如下:
元素 | 元素的性质或原子结构 |
X | 该元素的一种原子无中子 |
Y | 原子半径最大的短周期元素 |
Z | 第三周期元素中简单离子半径最小 |
M | 地壳中含量最多的元素 |
Q | 其氧化物是光导纤维的基本原料 |
W | 其核电荷数为M元素核电荷数的2倍 |
(1)X的无中子原子的符号为____________,Y的原子结构示意图为_____________,Q在元素周期表中的位置为___________________。
(2)Y、Z的最高价氧化物对应的水化物的碱性由强到弱的顺序是_______________________(用化学式表示),写出两者反应的离子方程式:__________________________________________。
(3)M、W两种元素中非金属性较强的是______________(用元素符号表示),下列表述中能证明这一事实的____________________(填序号),
a. 常温下,M的单质与W的单质的状态不同
b. 向W的氢化物中通入M2,有淡黄色固体析出
c. M、W形成的化合物中W元素为正价