题目内容
已知H-H键键能为436kJ/mol,H-N键键能为391kJ/mol,根据化学方程式:N2+3H2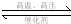 2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
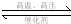 2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )
2NH3,反应1mol N2时放出92.4kJ的热量,则N≡N键键能是( )分析:在化学反应中,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,当旧键断裂吸收的能量大于新键生成释放的能量时,反应表现为吸热,当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热.
解答:解:假设N≡N键键能为x,根据在化学反应中,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值,
当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热,可以得到:x-436kJ/mol×3-391kJ/mol×6=-92.4kJ/mol,
解得x=945.6KJ/mol.
故选B.
当旧键断裂吸收的能量小于新键生成释放的能量时,反应表现为放热,可以得到:x-436kJ/mol×3-391kJ/mol×6=-92.4kJ/mol,
解得x=945.6KJ/mol.
故选B.
点评:本题考查学生化学反应能量变化的知识,旧键断裂吸收的能量和新键生成释放的能量之差即为反应的能量变化值是解题的关键.

练习册系列答案
相关题目
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是
| A.431 kJ·mol-1 | B.945.6 kJ·mol-1 |
| C.649 kJ·mol-1 | D.896 kJ·mol-1 |
 2NH3;ΔH=-92.4 kJ·mol-1
2NH3;ΔH=-92.4 kJ·mol-1