题目内容
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④熔点:SiO2>Na2O2>CO2.
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④熔点:SiO2>Na2O2>CO2.
| A、①③ | B、②④ | C、①④ | D、②③ |
考点:微粒半径大小的比较,非金属在元素周期表中的位置及其性质递变的规律,晶体的类型与物质熔点、硬度、导电性等的关系
专题:元素周期律与元素周期表专题
分析:①元素的非金属性越强,对应的氢化物越稳定;
②电子层越多,半径越大;同周期,原子序数大的半径小;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体.
②电子层越多,半径越大;同周期,原子序数大的半径小;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
④晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体.
解答:
解:A.非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,故①错误;
B.电子层越多,半径越大;同周期,原子序数大的半径小,则原子半径为Na>Mg>O,故②正确;
C.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
D.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>Na2O2>CO2,故④正确.
故选B.
B.电子层越多,半径越大;同周期,原子序数大的半径小,则原子半径为Na>Mg>O,故②正确;
C.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故③错误;
D.晶体的熔点一般为原子晶体>离子晶体>金属晶体>分子晶体,则熔点为SiO2>Na2O2>CO2,故④正确.
故选B.
点评:本题考查元素周期表和元素周期律的应用,为高频考点,把握元素的位置、性质的变化规律为解答的关键,侧重金属性、非金属性比较的考查,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列说法中,正确的是( )
| A、具有较高能量的分子是活化分子 |
| B、活化分子间的碰撞一定是有效碰撞 |
| C、反应的活化能大小不会影响化学反应速率 |
| D、不同化学反应需要的活化能有可能差别很大 |
下列离子方程式正确的是( )
| A、碳酸的电离 H2CO3?H++HCO3- |
| B、将金属钠加入水中 Na+2H2O═Na++2OH-+H2↑ |
| C、硫化钠水解 S2-+2H2O═H2S↑+2OH- |
| D、向氯化铝溶液中加入过量的烧碱溶液 Al3++3OH-═Al(OH)3↓ |
下列反应的离子方程式正确的是( )
| A、氢氧化钡跟稀硫酸反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| B、醋酸溶液与氢氧化钠溶液反应:H++OH-═H2O |
| C、碳酸钙跟盐酸反应:CO32-+2H+═CO2↑+H2O |
| D、氨水跟盐酸反应:OH-+H+═H2O |
若某原子在处于能量最低状态时,价电子排布为4d15s2,则下列说法正确的是( )
| A、该元素原子处于能量最低状态时,原子中共有3个未成对电子 |
| B、该元素原子核外共有5个能级 |
| C、该元素原子的M能层共有18个电子 |
| D、该元素原子最外能层共有3个电子 |
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.我市已将PM2.5列入空气质量播报指标.下列有关说法中不正确的是( )
| A、空气中PM2.5含量较高时,容易引起呼吸系统疾病 |
| B、国家应该大力开发和使用太阳能、风能、天然气等可再生能源来降低环境污染 |
| C、PM2.5的颗粒在空气中不一定能形成气溶胶 |
| D、研制开发燃料电池汽车,减少机动车尾气排放,某种程度可以减少空气中PM2.5含量 |
下列反应中转移电子的物质的量不等于2mol的是( )
| A、1mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B、1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C、1mol MnO2与含2mol H2O2的双氧水反应 |
| D、1mol Cu与含2mol H2SO4的浓硫酸共热 |
下列化学中的“实质”叙述不正确的是( )
| A、元素周期律的实质是元素的原子核外电子排布的周期性变化 |
| B、氧化还原反应的实质是化合价的改变 |
| C、化学键的实质是原子之间强烈的相互作用 |
| D、化学反应的实质是化学键旧键的断裂和新键的生成 |
用下列装置进行相应实验,能达到实验目的是( )
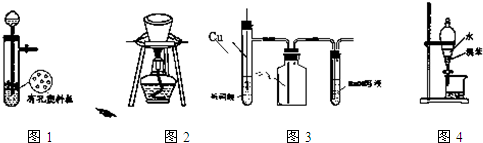

| A、图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 |
| B、图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
| C、图3所示装置用于制备并收集NO气体 |
| D、图4所示装置用于分离出溴苯 |