题目内容
(1)如图1表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界.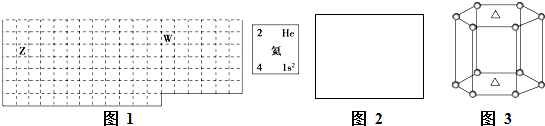
(2)元素X是第三周期ⅦA族元素,请在下边方框中按如图2氦元素的式样,写出元素X的原子序数、元素符号、元素名称、相对原子质量和价电子排布.
(3)元素Y的3p能级中只有1个电子,则Y原子半径与X原子半径较大的是 (用元素符号表示),X、Y的最高价氧化物对应水化物的酸性较强的是 (用化学式表示).
(4)Z和W是元素周期表中的两种元素,Z和W组成的一种化合物ZW2,刷新了金属化合物超导温度的最高纪录.如图3所示的是该化合物的晶体结构单元.图中上下底面中心“△”处的原子是 (填元素符号).

(2)元素X是第三周期ⅦA族元素,请在下边方框中按如图2氦元素的式样,写出元素X的原子序数、元素符号、元素名称、相对原子质量和价电子排布.
(3)元素Y的3p能级中只有1个电子,则Y原子半径与X原子半径较大的是
(4)Z和W是元素周期表中的两种元素,Z和W组成的一种化合物ZW2,刷新了金属化合物超导温度的最高纪录.如图3所示的是该化合物的晶体结构单元.图中上下底面中心“△”处的原子是
考点:元素周期表的结构及其应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:(1)第一周期只有2种元素,分别处于1、18列;第2、3周期中ⅡA、ⅢA族之间相隔10列;
(2)元素X是第三周期ⅦA族元素,则X为Cl元素,原子序数为17,元素名称为氯,相对原子质量为35.5,价电子排布为3s23p5;
(3)元素Y的3p能级中只有1个电子,则Y为Al,同周期自左而右原子半径减小;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强;
(4)由元素在周期表中位置,可知Z为Mg,W为B,根据均摊法计算晶胞中Mg、B原子数目,确定面心原子.
(2)元素X是第三周期ⅦA族元素,则X为Cl元素,原子序数为17,元素名称为氯,相对原子质量为35.5,价电子排布为3s23p5;
(3)元素Y的3p能级中只有1个电子,则Y为Al,同周期自左而右原子半径减小;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强;
(4)由元素在周期表中位置,可知Z为Mg,W为B,根据均摊法计算晶胞中Mg、B原子数目,确定面心原子.
解答:
解:(1)第一周期只有2种元素,分别处于1、18列;第2、3周期中ⅡA、ⅢA族之间相隔10列,用实线补全元素周期表边界为: ,
,
故答案为: ;
;
(2)元素X是第三周期ⅦA族元素,则X为Cl元素,原子序数为17,元素名称为氯,相对原子质量为35.5,价电子排布为3s23p5,按如图2氦元素的式样表示为: ,故答案为:
,故答案为: ;
;
(3)元素Y的3p能级中只有1个电子,则Y为Al,同周期自左而右原子半径减小,故原子半径Al>Cl;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,故酸性HClO4>Al(OH)3,故答案为:Al;HClO4;
(4)由元素在周期表中位置,可知Z为Mg,W为B,Z和W组成的一种化合物ZW2,面心原子数目为2×
=1,顶点原子数目为12×
=2,故面心原子为Mg,故答案为:Mg.
 ,
,故答案为:
 ;
;(2)元素X是第三周期ⅦA族元素,则X为Cl元素,原子序数为17,元素名称为氯,相对原子质量为35.5,价电子排布为3s23p5,按如图2氦元素的式样表示为:
 ,故答案为:
,故答案为: ;
;(3)元素Y的3p能级中只有1个电子,则Y为Al,同周期自左而右原子半径减小,故原子半径Al>Cl;同周期自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,故酸性HClO4>Al(OH)3,故答案为:Al;HClO4;
(4)由元素在周期表中位置,可知Z为Mg,W为B,Z和W组成的一种化合物ZW2,面心原子数目为2×
| 1 |
| 2 |
| 1 |
| 6 |
点评:本题考查元素周期表、元素周期律、晶胞计算等,难度不大,注意对元素周期表的整体把握,掌握元素周期律.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| V2O5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
同温同压下,下列热化学方程式中Q值最大的是(均为放热反应)( )
| A、2A(l)+B(l)═2C(g)△H=-Q1kJ/mol |
| B、2A(g)+B(g)═2C(g)△H=-Q2kJ/mol |
| C、2A(g)+B(g)═2C(l)△H=-Q3kJ/mol |
| D、2A(l)+B(l)═2C(l)△H=-Q4kJ/mol |
在一定温度下向饱和Na2SO4溶液中加入ag无水硫酸钠粉末,搅拌,静置后析出bg Na2SO4?10H2O晶体,(b-a)g是( )
| A、原饱和溶液失去的水的质量 |
| B、原饱和溶液中减少的硫酸钠的质量 |
| C、原饱和溶液中失去的水和硫酸钠的总质量 |
| D、析出的晶体含有的硫酸钠的质量 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 氧化铁 FeO |
| B、盐 纯碱 Na2CO3 |
| C、酸 硫酸 H2S |
| D、酸性氧化物 碳酸气 C0 |