题目内容
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| V2O5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
考点:化学反应速率的影响因素
专题:
分析:A.根据催化剂可以同等程度的增大正逆反应的反应速率;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.降低温度,反应速率减小;
D.根据v=
计算判断.
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.降低温度,反应速率减小;
D.根据v=
| △c |
| △t |
解答:
解:A.催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B.若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C.降低温度,反应速率减小,达到平衡的时间增多,故C错误;
D.根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=
,故D正确.
故选D.
B.若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C.降低温度,反应速率减小,达到平衡的时间增多,故C错误;
D.根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=
| c2-c1 |
| t2-t1 |
故选D.
点评:本题主要考查化学反应速率与化学平衡的影响的因素,化学反应速率计算等,B选项为易错点,注意理解压强对反应速率、化学平衡的影响,改变压强影响物质的浓度.

练习册系列答案
相关题目
下列物质分类正确的是( )
A、 芳香族化合物 芳香族化合物 |
B、 羧酸 羧酸 |
C、 醛 醛 |
D、 酚 酚 |
将BaO2放入密闭真空容器中,反应BaO2(s)?BaO(s)+
O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| 1 |
| 2 |
| A、氧气压强不变 | ||||
| B、BaO质量增加 | ||||
| C、BaO2质量不变 | ||||
D、平衡常数K=
|
下列有关物质的性质和该性质的应用均正确的是( )
| A、Na2O2是碱性氧化物,能与CO2、H2O反应作供氧剂 |
| B、浓硫酸具有强氧化性,常温下可用铝罐盛装 |
| C、SO2利Cl2均具有漂白性,两者混合使用可以增强漂白效果 |
| D、氯气具有酸性,可与烧碱或石灰乳反应制取含氯消毒剂 |
下列分子或离子在指定条件的分散系中能大量共存的是( )
| A、Ca(NO3)2溶液中:Fe2+、H+、Cl-、SO42- |
| B、使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32- |
| C、水电离出的c(H+)=10-12 mol?L-1的溶液中:Na+、Ba2+、HCO3-、CH3COO- |
| D、透明的强酸性溶液中:Al3+、Fe3+、Cl-、SO42 |
下列有关叙述中正确的是( )
| A、因为s轨道的形状是球形的,所以s电子做的是圆周运动 |
| B、3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 |
| C、原子轨道和电子云都是用来形象地描述电子运动状态的 |
| D、H2、F2、HCl和H2O中的σ键都是sp σ键 |
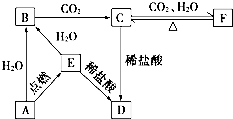 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.