题目内容
1.在标准状况下,1mol气体的体积约是22.4L,在非标准状况下,1mol气体的体积则一定不是22.4L错(判断对错)分析 由PV=nRT可知,气体的体积取决于气体存在的温度和压强,以此解答该题.
解答 解:气体的体积取决于气体存在的温度和压强,升高温度体积增大,增大压强体积减小,在一定的温度和压强下,如不是标准状况,1mol气体的体积可能为22.4L,如温度高于0℃时,压强增大,1mol气体的体积可能为22.4L,
故答案为:错.
点评 本题考查阿伏伽德罗定律及应用,难度不大,注意体积相等时,气体的物质的量是否相等,要取决于气体存在的温度和压强是否相等,只有在同温同压下,气体的气体摩尔体积才相等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.实验室用锌与盐酸反应制取氢气.下列措施中,能加快反应速率的是( )
| A. | 降低温度 | B. | 用铁代替锌 | C. | 增大盐酸浓度 | D. | 用锌粒代替锌粉 |
12.下列在溶液中能大量共存的离子组是( )
| A. | K+、H+、SO42-、CO32- | B. | H+、Ba2+、NO3-、HCO3- | ||
| C. | Ba2+、Mg2+、Cl-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
16.磷酸盐缓冲溶液对维持生物体内的正常pH和正常生理环境起重要作用.将0.2mol•L-1的NaH2PO4与0.2mol•L-1的Na2HPO4溶液以不同比例混合,可形成不同pH的缓冲溶液.
试回答下列问题:
(1)在pH=5.9的磷酸盐缓冲溶液中,c(Na+)=0.22mol/L(溶液混合时的体积变化忽略不计).
(2)欲直接利用NaH2PO4•2H2O和Na2HPO4•2H2O配制100mLpH=5.8的NaH2PO4-Na2HPO4缓冲溶液,需称量NaH2PO4•2H2O、Na2HPO4•2H2O的质量分别为2.87g、0.285g.
| pH | NaH2PO4溶液体积/mL | Na2HPO4溶液体积/mL |
| 5.7 | 93.5 | 6.5 |
| 5.8 | 92 | 8 |
| 5.9 | 90 | 10 |
| 6.0 | 87.7 | 12.3 |
(1)在pH=5.9的磷酸盐缓冲溶液中,c(Na+)=0.22mol/L(溶液混合时的体积变化忽略不计).
(2)欲直接利用NaH2PO4•2H2O和Na2HPO4•2H2O配制100mLpH=5.8的NaH2PO4-Na2HPO4缓冲溶液,需称量NaH2PO4•2H2O、Na2HPO4•2H2O的质量分别为2.87g、0.285g.
6.某溶液中含有HCO3-,CO32-,SO32-,Na+,NO3-五种离子,若向其中加入足量的试剂Q,充分反应后溶被中有n种离子(不考虑水电离出的离子)的物质的量保持不变,下列有关Q、n的分析中错误的是( )
| 选项 | A | B | C | D |
| Q | Na2O2 | SO2 | BaCl2 | AlCl3 |
| n | 1 | 1 | 4 | 2 |
| A. | A | B. | B | C. | C | D. | D |
5.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类.PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害.下列有关叙述不正确的是( )
| A. | PE、PVC都属于链状高分子化合物,无固定熔点 | |
| B. | PE、PVC的单体都是不饱和烃,能使溴水褪色 | |
| C. | 焚烧PVC保鲜膜会放出有毒气体如HCl | |
| D. | 废弃的PE和PVC均可回收利用以减少白色污染 |

 .
.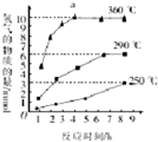 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.