题目内容
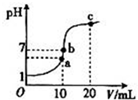 (2013?泰安三模)25℃时,在20mL 0.1mol?L-1盐酸中逐滴加入0.2mol?L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是( )
(2013?泰安三模)25℃时,在20mL 0.1mol?L-1盐酸中逐滴加入0.2mol?L-1的氨水,溶液的pH与所加氨水的体积关系如图所示,下列有关粒子浓度的关系不正确的是( )分析:根据图象知,a点溶液呈酸性,b点呈中性,氨水应稍过量,c点呈碱性,根据溶液的酸碱性及电荷守恒确定离子浓度关系.
解答:解:A.B点对应的溶质为NH4Cl和NH3?H2O,溶液呈中性,氨水应稍过量,故A错误;
B.在b点:溶液呈中性,所以c(H+)=c(OH-),溶液中存在电荷守恒,即c(Cl-)+c(OH-)=c(H+)+c(NH4+),所以c(NH4+)=c(Cl-),故B正确;
C.在a点,溶液呈酸性,c(H+)>c(OH-),由电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(NH4+),所以c(Cl-)>c(NH4+),根据图象知,溶液的pH接近7,所以溶液中c(NH4+)>c(H+),故C正确;
D.在c点,氨水的物质的量是盐酸物质的量的2倍,根据物料守恒知,c(NH4+)+c(NH3.H2O)=2c(Cl-),故D正确;
故选A.
B.在b点:溶液呈中性,所以c(H+)=c(OH-),溶液中存在电荷守恒,即c(Cl-)+c(OH-)=c(H+)+c(NH4+),所以c(NH4+)=c(Cl-),故B正确;
C.在a点,溶液呈酸性,c(H+)>c(OH-),由电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(NH4+),所以c(Cl-)>c(NH4+),根据图象知,溶液的pH接近7,所以溶液中c(NH4+)>c(H+),故C正确;
D.在c点,氨水的物质的量是盐酸物质的量的2倍,根据物料守恒知,c(NH4+)+c(NH3.H2O)=2c(Cl-),故D正确;
故选A.
点评:本题考查酸碱的混合以及离子浓度的大小比较,题目难度较大,注意盐酸和氨水恰好完全反应时溶液不呈中性,要使溶液呈中性,氨水应稍微过量,为易错点.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目