题目内容
13.用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空.2NaCl+2H2O$\stackrel{通直流电}{→}$2NaOH+Cl2↑+H2↑
该氧化还原反应中,氧化产物为Cl2;被还原的元素是H.
分析 该反应中,氯元素化合价由-1价变为0价,氢元素化合价由+1价变为0价被还原,所以氯化钠失电子为还原剂生成Cl2为氧化产物,水得电子,所以电子从氯化钠转移到水,转移电子数为2.
解答 解:该反应中,氯元素化合价由-1价变为0价,氢元素化合价由+1价变为0价被还原,所以氯化钠失电子为还原剂生成Cl2为氧化产物,水得电子,所以电子从氯化钠转移到水,转移电子数为2,其转移电子的方向和数目为: ,
,
故答案为:Cl2;H; .
.
点评 本题主要考查的是氧化还原反应的基本概念、单线桥法表示氧化还原反应等,难度不大.

练习册系列答案
相关题目
4.下列对实验操作的叙述错误的是( )
| A. | 用胶头滴管加液时,一般不能伸入试管中 | |
| B. | 蒸馏时一般需在瓶内放一些碎瓷片 | |
| C. | 温度计插入液体中测量温度的同时,又用它搅拌液体 | |
| D. | 用10 mL的量筒可量取5.4mL溶液 |
4.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| A. | 过氧化钠用于呼吸面具中是因为过氧化钠是强氧化剂能氧化CO2和水 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 用热的纯碱溶液洗去油污原理是NaHCO3溶液水解显碱性 |
1.据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故.截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散.当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 ( )
| A. | NaOH | B. | NaCl | C. | KBr | D. | Na2CO3 |
5.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,明显不正确的是( )


| A. | 稀释浓盐酸过程 | |
| B. | 向氯化铝溶液中滴加氢氧化钠溶液至过量 | |
| C. | 分散系的分类 | |
| D. | 氨水与SO2反应后溶液中的铵盐 |
3. 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )| A. | X、Y、Z、W均为含有同种元素的化合物 | |
| B. | 若X能与Y反应,则X、Y-定是H2S和SO2 | |
| C. | Z→W的反应一定是氧化还原反应 | |
| D. | 在W的稀溶液滴入石蕊试剂都显红色 |
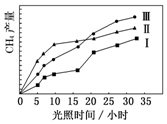 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示. 化学电池在通讯、交通及日常生活中有着广泛的应用.
化学电池在通讯、交通及日常生活中有着广泛的应用.