题目内容
2.(1)含铁元素的物质有很多,在生产、生活中应用广泛.请填写以下空格:指出下列化合物中铁元素的化合价:Na2FeO4+6 Fe2O3+3 FeO+2
取少量某油漆的原料Fe2O3(红棕色粉末)并加入适量浓盐酸,反应后得到棕黄色的溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到有沉淀生成,生成沉淀的离子方程式Fe3++3OH-═Fe(OH)3↓.另在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至液体呈红褐色,停止加热,证明所得分散系类型的实验方法的名称是丁达尔效应.
(2)纯净物根据其组成和性质可进行如下分类:

上图所示的分类方法属于B(填序号)
A.交叉分类法 B.树状分类法
下列2组物质中均有一种物质的类别与其它2种不同
A.CaO、Na2O、SiO2 B.Al(OH)3、KOH、Ba(OH)2
以上两组物质中,每组里与别的两物质的类别明显不同的物质依次是(填化学式)SiO2;Al(OH)3.
写出能用离子方程式CO32-+2H+═CO2↑+H2O表示的一个化学反应方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
分析 (1)化合物中正负化合价的代数和为0;氧化铁与盐酸反应生成氯化铁,氯化铁与NaOH反应生成红褐色沉淀Fe(OH)3,铁离子在热水中水解生成Fe(OH)3胶体,丁达尔现象为胶体特有的性质;
(2)由图可知,存在包含关系,为树状分类法;A中二氧化硅为酸性氧化物,B中氢氧化铝为两性氢氧化物,分别与其它两种不同类;CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,以此来解答.
解答 解:(1)合物中正负化合价的代数和为0,则Na2FeO4中Fe元素的化合价为0-(-2)×4-(+1)×2=+6;Fe2O3中Fe元素的化合价为+3,FeO中Fe元素的化合价为+2;取少量某油漆的原料Fe2O3(红棕色粉末)并加入适量浓盐酸,反应后得到棕黄色的溶液,取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到有沉淀生成,生成沉淀的离子方程式为Fe3++3OH-═Fe(OH)3↓.另在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至液体呈红褐色,停止加热,证明所得分散系类型的实验方法的名称是丁达尔效应,
故答案为:+6;+3;+2;Fe3++3OH-═Fe(OH)3↓;红褐;丁达尔效应;
(2)由图可知,存在包含关系,为树状分类法,则选B;A中二氧化硅为酸性氧化物,其它两种为碱性氧化物,而B中氢氧化铝为两性氢氧化物,其它两种为碱;CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:B;SiO2;Al(OH)3;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题考查物质的分类及胶体制备、元素化合价计算等,综合性较强,注重基础知识的考查,把握相关概念、分类方法为解答的关键,题目难度不大.

| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 在澄清的石灰水中通入过量SO2:SO2+OH-═HSO3- | |
| C. | Al片与少量NaOH溶液反应,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| A. | Na2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | |
| B. | 反应①中,NaCl是氧化产物 | |
| C. | 反应①为氧化还原反应,反应②为复分解反应 | |
| D. | 若有2mol FeCl3发生反应,转移电子的物质的量为6mol |
已知:
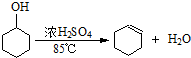
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
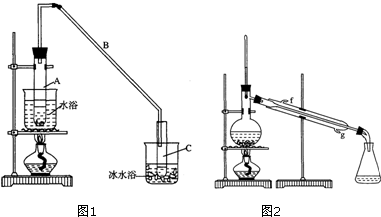
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②加热试管A采用热水浴,而非直接加热.目的是控制温度85℃左右,防止环己醇挥发,使受热均匀,试管C置于冰水浴中的目的是冷凝环己烯,防止其挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填字母).
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验
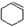 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②) (填序号)①和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液.
| A. | 标准状况下11.2L的水中含有0.5个NA水分子 | |
| B. | 0.1mol•L-1 NaCl溶液中Na+的数目为0.1NA | |
| C. | 1mol H2和O2的混合气体中含NA个分子 | |
| D. | 在常温常压下,18克水含有的原子数为3NA |
| A. | 天然气的主要成分 | |
| B. | 最简单的有机物 | |
| C. | 二氯取代物有两种结构 | |
| D. | 与氯气在光照条件下能发生取代反应 |
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不可食用 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 酸钡难溶于水和酸,可做X光透视肠胃的药剂 |

 ;
; .
.
 ;
; 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯; -C≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
-C≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.