题目内容
15.丙酮、丁醛、葡萄糖的混合物,碳元素的质量分数为66%,则氧元素的质量分数为( )| A. | 33% | B. | 27% | C. | 30% | D. | 23%? |
分析 丙酮(C3H6O)、丁醛(C4H8O)、葡萄糖(C6H12O6)组成的混合物中C、H两种元素的原子个数之比始终是1:2,故C、H两元素的质量之比=12:2=6:1,据此根据C元素质量计算H元素的质量分数,再根据ω(O)=1-ω(H)-ω(C)计算.
解答 解:丙酮(C3H6O)、丁醛(C4H8O)、葡萄糖(C6H12O6)组成的混合物中C、H两种元素的原子个数之比始终是1:2,故C、H两元素的质量之比=12:2=6:1,混合物中碳元素的质量分数为66%,则ω(H)=66%×$\frac{1}{6}$=11%,故ω(O)=1-ω(H)-ω(C)=1-11%-66%=23%,
故选D.
点评 本题考查混合物中元素的质量分数的计算,关键是利用混合物中各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
相关题目
5.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠溶液 | B. | 醋酸钾固体 | C. | 硫酸钾固体 | D. | 硝酸钠溶液 |
6.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法错误的是( )

| A. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| B. | 石灰乳是该工业用到的原料之一 | |
| C. | 在过程③⑤中溴元素均被氧化 | |
| D. | 工业上电解饱和MgCl2溶液制备金属镁 |
3.化学与社会、科学、技术、环境等密切联系.下列有关化学诠释正确的是( )
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | Al2(SO4)3可用于对自来水进行消毒 | |
| C. | 大型制冷设备的液氨大量泄漏不会对操作人员有损害 | |
| D. | 静电除尘与胶体性质相关 |
20.下列各表述与示意图一致的是( )
| A. | 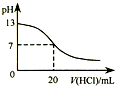 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 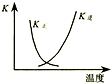 图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 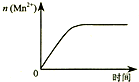 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 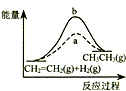 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
7.将某些化学知识用图象表示,可以收到直观、简明的效果.如图图象所表示的化学知识中,错误的是( )
| A. |  分散系的分类 | B. |  稀释浓硫酸的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴入盐酸 | D. |  比较Na2CO3、NaHCO3的稳定性 |
18.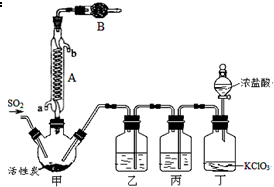 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
(1)仪器A冷却水的进口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验时,装置丁中发生反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(4)装置丙的作用为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
(1)仪器A冷却水的进口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验时,装置丁中发生反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(4)装置丙的作用为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.