题目内容
9.关于下列各图的叙述,正确的是( )
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6KJ•mol-1 | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
分析 A.表示燃烧热时应生成液态水.
B.可逆反应2NO2?N204(g)中,分析判断 二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1,说明反应达到平衡状态;
C.A、B两物质的溶解度均随温度升高而增大,由t1℃升温至t2℃时,A、B溶液浓度不变;
D.酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大.
解答 解:A.表示燃烧热时应生成液态水,而图中为气态水,不是最稳定的物质,则不能表示为燃烧热,故A错误.
B.可逆反应2NO2?N204(g)中,分析判断,二氧化氮消耗速率和四氧化二氮的消耗速率之比为2:1时才能说明反应达到平衡状态,交点只是浓度相同不能证明达到终点,故B错误;
C.A、B两物质的溶解度均随温度升高而增大,由t1℃升温至t2℃时,A、B溶液浓度均不变,都没有达到饱和溶液,故C错误;
D.依据图象乙,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液PH变化大,酸性HA>HB,同浓度的NaA溶液的pH小于NaB溶液,故D正确.
故选D.
点评 本题考查较为综合,以图象为载体考查学生的分析能力,为高考常见题型和高频考点,题目测总考查化学反应能量守恒判断,弱电解质溶液稀释后溶液酸性强弱比较,注意把握图象曲线变化的意义,把握相关基本反应原理的理解,题目难度中等.

练习册系列答案
相关题目
20.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )

| A. | 在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-1 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
17.下列各组物质在一定条件下反应,可以制得较纯净的氯乙烷的是( )
| A. | 乙烷与氯气取代 | B. | 乙烯与氢气加成,再用氯气取代 | ||
| C. | 乙烯与氯化氢加成 | D. | 乙烯与氯气加成 |
4.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 0.1 mol/LFeCl3溶液中大量存在:Fe2+、NH4+、SCN-、SO42- | |
| C. | 加入Al粉产生H2的溶液中可能大量存在:K+、Na+、NO3-、Cl- | |
| D. | 中性溶液中可能大量存在:Fe3+、K+、Cl-、SO42- |
14.硅是目前半导体工业中最重要的基础原料,其导电性对哦杂质等十分敏感,因此,必须制备高纯度硅.虽然地壳中硅的含量丰富,但大多数以化合物形式存在,需要通过化学方法来制备高纯度的单晶硅,一种简单工艺流程如下:

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
提纯SiHCl3的主要工艺操作依次为沉降、冷凝、精馏,其中精馏温度最好控制在31.8℃.
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.
1. X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )
X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )
 X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )
X、Y、Z、W是中学常见的四种短周期元素,其原子序数依次增大,且原子核外最外层电子数都不少于2,X的族序数与最外层电子数相等.四种元素的单质均能在氧气中燃烧,生成四种相对分子质量都大于26的氧化物,其中有两种氧化物能溶于稀硫酸,三种能溶于烧碱溶液.四种元素单质的混合物有如下性质:下列说法正确的是( )| A. | 原子半径:X>Y>Z>W | |
| B. | 简单气态氮化物的热稳定性:W>X | |
| C. | 最高价氧化物对应的水化物的碱性:Z>Y | |
| D. | X和W组成的化合物常作砂纸、砂轮的磨料 |
16.某有机物的结构如图所示,下列说法正确的是( )
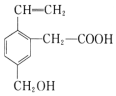

| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
17.下列对分子性质的解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键 | |
| B. | 乳酸有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释 | |
| D. | 酸性:HClO4>HClO,因为HClO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |