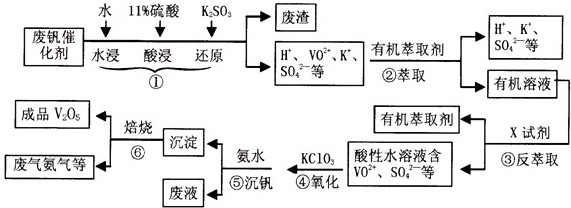
题目内容
将94%的硫酸溶液40g加水稀释到质量分数为20%,需要加水量是
- A.126 g
- B.148 g
- C.153 g
- D.165 g

苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:

(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号)。
A. B.
B. C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面)。
(3)经反应④得到的产物除 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在 、SO32-、HSO3-,写出实验步骤、预期现象和结论。
、SO32-、HSO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol·L-1盐酸、1mol·L-1 BaCl2溶液、品红溶液、0.01 mol·L-1酸性KMnO4溶液、1 mol·L-1 FeCl3溶液、饱和溴水等。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量待测液于试管中,加入足量的1 mol·L-1BaCl2溶液,静置、过滤,得滤液和沉淀。将滤液分置于试管A、B中,沉淀置于试管C中。 |
|
|
步骤2:往试管A中加入 。 |
,说明溶液中含有HSO3-。 |
|
步骤3:往试管B中加入 。 |
。 |
|
步骤4:往试管C中加入2 mol·L-1盐酸酸化,再滴入1~2滴品红溶液。 |
,说明溶液中含有SO32-。 |
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 。(苯酚的分子式为C6H6O,三溴苯酚的分子式为C6H3Br3O,它们的相对分子质量分别为94、331)
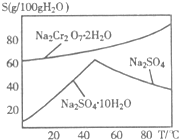 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下: