题目内容
TiO2在很多领域有着广泛的应用前景.
(1)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2.已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液的pH=2,则此时溶液中c(Ti4+)= .
(2)制备纳米TiO2的方法:以N2为载体,用钛醇盐Ti(OR)4和水蒸气反应生成Ti(OH)4,再控制温度生成纳米TiO2.温度控制不当会使产物含结晶水,测定产物aTiO2?bH2O组成的方法如下:
步骤一:取样品2.010g,在酸性条件下充分溶解,并用适量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液.
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol?L-1NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+.重复滴定2次.滴定所得的相关数据如表:
①钛醇盐Ti(OR)4和水蒸气反应的化学方程式为 .
②步骤一中用稀硫酸而不用水定容的原因是 .
③通过计算确定该样品的组成 (写计算过程).
(1)制备TiO2的常见方法:将TiCl4水解产物加热脱水生成TiO2.已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液的pH=2,则此时溶液中c(Ti4+)=
(2)制备纳米TiO2的方法:以N2为载体,用钛醇盐Ti(OR)4和水蒸气反应生成Ti(OH)4,再控制温度生成纳米TiO2.温度控制不当会使产物含结晶水,测定产物aTiO2?bH2O组成的方法如下:
步骤一:取样品2.010g,在酸性条件下充分溶解,并用适量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液.
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000mol?L-1NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+.重复滴定2次.滴定所得的相关数据如表:
| 滴定 序号 |
待测液体积/mL | NH4Fe(SO4)2标准溶液 滴定管起点读数/mL |
NH4Fe(SO4)2标准溶液 滴定管终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②步骤一中用稀硫酸而不用水定容的原因是
③通过计算确定该样品的组成
分析:(1)根据Ti(OH)4的溶解平衡利用溶度积常数来解答;
(2)①根据题目信息以及原子守恒来分析;
②根据TiO2+和Ti3+发生水解溶液呈算性;
③先根据三次滴定消耗标准溶液的体积求出平均值,然后根据关系式TiO2 ~NH4Fe(SO4)2求出TiO2 的质量,从而求出水的质量,最终求出a:b;
(2)①根据题目信息以及原子守恒来分析;
②根据TiO2+和Ti3+发生水解溶液呈算性;
③先根据三次滴定消耗标准溶液的体积求出平均值,然后根据关系式TiO2 ~NH4Fe(SO4)2求出TiO2 的质量,从而求出水的质量,最终求出a:b;
解答:解:(1)测得TiCl4水解后溶液的pH=2,所以溶液中的C(OH-)=10-12mol?L-1,c(Ti4+)=
=
=7.94×10-6 mol?L-1,故答案为:7.94×10-6 mol?L-1;
(2)①钛醇盐Ti(OR)4和水蒸气反应生成Ti(OH)4,根据原子守恒生成醇ROH,方程式为:Ti(OR)4+4H2O(g)
Ti(OH)4+4ROH,
故答案为:Ti(OR)4+4H2O(g)
Ti(OH)4+4ROH,
②TiO2+和Ti3+发生水解溶液呈酸性,步骤一中用稀硫酸而不用水定容的原因是抑制Ti3+(TiO2+)的水解,故答案为:Ti3+(TiO2+)的水解;
③三次滴定消耗标准溶液的平均值为24.00mL,
TiO2 ~NH4Fe(SO4)2
80g 1mol
m(TiO2) 0.02400L×0.1000 mol?L-1×
m(TiO2)=1.920g,则m(H2O)=2.010g-1.920 g=0.090 g
所以a:b=
:
=24:5,该样品的组成为24TiO2?5H2O,
故答案为:24TiO2?5H2O;
| Ksp |
| C4(OH-) |
| 7.94×10 -54 |
| (10 -12)4 |
(2)①钛醇盐Ti(OR)4和水蒸气反应生成Ti(OH)4,根据原子守恒生成醇ROH,方程式为:Ti(OR)4+4H2O(g)
| ||
故答案为:Ti(OR)4+4H2O(g)
| ||
②TiO2+和Ti3+发生水解溶液呈酸性,步骤一中用稀硫酸而不用水定容的原因是抑制Ti3+(TiO2+)的水解,故答案为:Ti3+(TiO2+)的水解;
③三次滴定消耗标准溶液的平均值为24.00mL,
TiO2 ~NH4Fe(SO4)2
80g 1mol
m(TiO2) 0.02400L×0.1000 mol?L-1×
| 250mL |
| 25.00mL |
m(TiO2)=1.920g,则m(H2O)=2.010g-1.920 g=0.090 g
所以a:b=
| 1.920g |
| 80g?mol-1 |
| 0.090g |
| 18g?mol-1 |
故答案为:24TiO2?5H2O;
点评:本题主要以物质的制备为背景,考查了可溶度积的计算、方程式的书写和化学计算,难度不大,根据课本知识即可完成.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
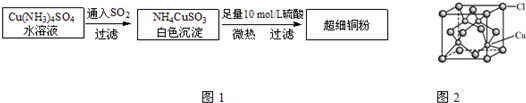
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.

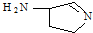 ,则分子中σ键与π键之比为
,则分子中σ键与π键之比为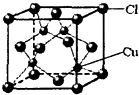 所示,该化合物的化学式为
所示,该化合物的化学式为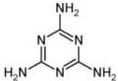 ).
).