题目内容
实验室用铁粉制备摩尔盐的操作流程如下:

(1)流程中“趁热”过滤的原因是__________。
(2)检验反应1溶液中是否含Fe3+的实验方法为___________。
(3)为确定摩尔盐的化学式,进行如下实验:现称取4.704g新制摩尔盐,溶于水配制成100.0mL溶液,再将该溶液分成两等份。向其中一份溶液中加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色石蕊试纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色,用足量稀盐酸处理沉淀物,充分反应后过滤、洗涤和干燥,得白色固体2.796g。另一份溶液用0.0500mol·L-1K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗K2Cr2O7溶液的体积为20.00mL。
①25℃时,Ksp(BaSO4)=1.1×10-10,若要使溶液中SO42-离子沉淀完全(即该离子浓度须小于1×10-5mol·L-1),则此时c[(Ba(OH)2]≥________mol·L-1。
②确定该摩尔盐的化学式(写出计算过程)。________
 阅读快车系列答案
阅读快车系列答案煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
下列实验操作、现象与结论对应关系不正确的是
选项 | 操作 | 现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是NO2 |
B | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+能力比CO32-强 |
C | 向NaHCO3溶液中加入醋酸,将产生的气体 直接通入苯酚钠溶液中 | 产生白色沉淀 | 酸性:醋酸>碳酸>苯酚 |
D | 浓度均为0.10mol/L的 Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
A. A B. B C. C D. D



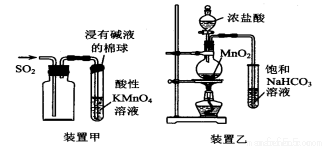

 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l