题目内容
【题目】葡萄糖酸锌是一种常见的补锌药物,常用葡萄糖酸和![]() 反应制备。
反应制备。
(1)![]() 基态核外电子排布式为________。
基态核外电子排布式为________。
(2)![]() 的空间构型为________(用文字描述);
的空间构型为________(用文字描述);![]() 与
与![]() 反应能生成
反应能生成![]() ,不考虑空间构型,
,不考虑空间构型,![]() 的结构可用示意图表示为________。
的结构可用示意图表示为________。
(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测葡萄糖酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
(4)用![]() 可以制备
可以制备![]() ,一个
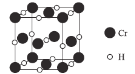
,一个![]() 晶胞(如图2)中,
晶胞(如图2)中,![]() 的数目为________。
的数目为________。
【答案】![]() 或
或![]() 正四面体
正四面体 
![]() 、
、![]() 易溶于水 4
易溶于水 4
【解析】
(1)Zn原子序数为30,Zn2+失去了2个电子,基态核外电子排布式为![]() ;
;
(2)根据价电子理论,可推出空间构型。
(3)根据有机物空间结构,推断碳原子轨道杂化类型。
(4)根据晶胞的结构,结合立体几何知识可看出Zn2+离子数量。
(1)根据电子排布结构,![]() 基态核外电子排布式为
基态核外电子排布式为![]() 或
或![]() 。
。
(2) ![]() 中心S原子价层电子对数
中心S原子价层电子对数![]() ,故为正四面体,
,故为正四面体,![]() 配合物中,铜原子提供空轨道,
配合物中,铜原子提供空轨道,![]() 中氧原子提供孤电子对,
中氧原子提供孤电子对,![]() 与4个
与4个![]() 形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为
形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为 。
。
(3) 羧基中碳原子是![]() ,其余碳原子是
,其余碳原子是![]() 。葡萄糖酸中含有5个羟基和1个羧基,都是亲水基团,故易溶于水。
。葡萄糖酸中含有5个羟基和1个羧基,都是亲水基团,故易溶于水。
(4)由图2可知,Y为锌离子,一个![]() 晶胞中,
晶胞中,![]() 的数目为4。
的数目为4。

【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____,直到因加入一滴盐酸后,溶液由______色变为____色,并____为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,所用盐酸溶液的体积为_____mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 25.31 | 25.09 |
依据表中数据列式计算该NaOH溶液的物质的量浓度_____(保留两位小数)。
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
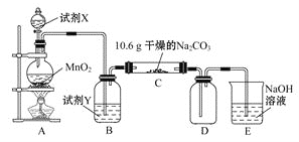
(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A | B | C | D | |
图示 |
|
|
|
|
相关 信息 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.AB.BC.CD.D