题目内容
 已知常温下E为最常见的无色无味液体,F为淡黄色粉末,G为常见的气体单质(反应条件均已省略).
已知常温下E为最常见的无色无味液体,F为淡黄色粉末,G为常见的气体单质(反应条件均已省略).请回答下列问题:
(1)请写出反应②的化学方程式
(2)若A为黑色固体,C、D均为气体且都能使澄清石灰水变浑浊,则A为
(3)若A为黄绿色气体,C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中反应①的离子方程式:
(4)若A与B均为固体化合物,C是一种能使红色石蕊试纸变蓝的气体,则反应①的化学方程方程式为
分析:E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体,则E为H2O,F为Na2O2,G为O2,反应①为常温下的反应,反应①中生成三种物质,其中有水,则可能为氯气与碱的反应,所以A为Cl2,B为NaOH(或KOH等),反应①还可能为C和浓硫酸的反应,或氯化铵与碱石灰生成氯化钙、水、氨气的反应,以此来解答.
解答:解:E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体,则E为H2O,F为Na2O2,G为O2,
(1)反应②为过氧化钠与水的反应,其化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)C、D是两种均能使澄清的石灰水变浑浊的无色气体,即C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,反应中S元素的化合价降低,体现其氧化性,故答案为:C;氧化;
(3)若A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则A是氯气,与碱反应,反应①生成盐酸盐、次氯酸盐和水,该离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)A与B均为固体化合物,C是一种能使红色石蕊试纸变蓝的气体,C为氨气,则反应①的化学方程方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,氨气的密度比空气的小,常用向下排空气法收集,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;向下排空气法.
(1)反应②为过氧化钠与水的反应,其化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)C、D是两种均能使澄清的石灰水变浑浊的无色气体,即C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,反应中S元素的化合价降低,体现其氧化性,故答案为:C;氧化;
(3)若A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则A是氯气,与碱反应,反应①生成盐酸盐、次氯酸盐和水,该离子反应为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)A与B均为固体化合物,C是一种能使红色石蕊试纸变蓝的气体,C为氨气,则反应①的化学方程方程式为2NH4Cl+Ca(OH)2
| ||
| ||
点评:本题考查无机物的推断,明确物质的性质(状态、颜色等)即可解答,熟悉氯气、过氧化钠的有关反应是解答的关键,侧重元素化合物之间转化的考查,综合性较强,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 N2+3H2
N2+3H2 N2O4
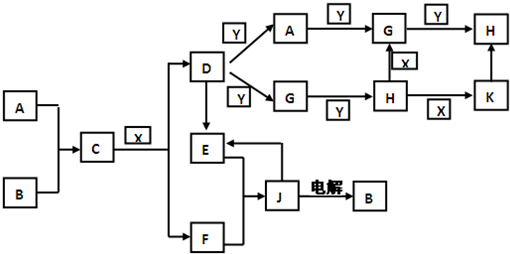
N2O4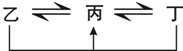 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: