题目内容
1.下列操作中,完全正确的一组是( )①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过$\frac{1}{3}$容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热.
| A. | ①④⑦⑩ | B. | ①③④⑤⑦⑩ | C. | ①④⑤⑦⑧⑨⑩ | D. | ②③④⑤⑥⑦⑩ |
分析 ①试管夹夹持试管时,从下向上套,离试管口$\frac{1}{3}$处;
②试管中的液体加热最好不超过容积的$\frac{1}{3}$;
③有些其他有刺激性气味、有毒不能吸入过多;
④取用固体需要借助纸条送入试管底部;
⑤依据取用液体试剂的规范操作要求分析判断;
⑥从玻璃仪器的基本操作分析判断;
⑦从坩埚钳的用途,蒸发皿的使用分析;
⑧依据胶头滴管使用方法分析;
⑨依据浓硫酸的稀释操作中的试剂顺序分析判断;
⑩依据检验装置气密性的方法进行分析判断,利用装置中的压强变化来检验.
解答 ①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部,故①正确;
②给试管中的液体加热,为避免液体沸腾时飞溅出来,液体的体积不能超过试管容积的$\frac{1}{3}$,故②错误;
③不能把鼻孔靠近容器口去闻气体的气味,要用手轻轻闪少量气体进入鼻孔,故③错误;
④将固体粉末倒入试管中时,把试管平放,用纸槽往试管里送入固体粉末,然后缓慢竖立试管,故④正确;
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时瓶上的标签对着地面,会使残留的液体腐蚀标签,应该标签朝着手心,故⑤错误;
⑥将烧瓶放在桌上,用力塞紧塞子,容易把烧杯口弄破,这些玻璃仪器都是很脆弱的,塞塞子要慢慢的旋紧,故⑥错误;
⑦坩埚钳可用于移走正在加热或很热的蒸发皿,是实验基本操作的要求,故⑦正确;
⑧滴管垂直悬空不能伸进试管内,故⑧错误;
⑨稀释浓硫酸时,应把浓硫酸沿烧杯内壁慢慢加入水中,并不断搅拌,因为水的密度比浓硫酸小,把水加入浓硫酸,溶解过程中温度升高容易引起液体飞溅引起安全事故,量筒是量取液体体积的量具,不能用来溶解液体,故⑨错误;
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热,导气管口处有气泡冒出,松开手,导气管中上升一段水柱,证明气密性完好,故⑩正确;
综上所述①④⑦⑩正确.
故选A.
点评 本题考查了化学实验的基本操作要求,主要是试剂的取用方法,试管的加热,蒸发皿的使用,浓硫酸的稀释,装置气密性的检验方法,熟练掌握实验仪器和基本操作的规范要求是学习实验的要求,题目难度中等.

| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 |
 ,则R元素在元素周期表中位于( )
,则R元素在元素周期表中位于( )| A. | 第三周期0族 | B. | 第四周期IA族 | C. | 第三周期IA族 | D. | 第三周期VIIA族 |
| A. | $\frac{N}{{N}_{A}}$ | B. | $\frac{4N}{{N}_{A}}$ | C. | $\frac{N}{4{N}_{A}}$ | D. | $\frac{3N}{4{N}_{A}}$ |
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-15 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位),(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中个慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
| A. | 纯碱 | B. | 乙酸乙脂 | C. | 石碳酸 | D. | 2,4,6-三溴笨酚 |
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,观察是否褪色 | |
| D. | 提取溶解在水中的少量碘:加入乙醇振荡、静置分层后,再将有机层分离 |
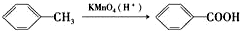
 (苯胺,易被氧化)
(苯胺,易被氧化)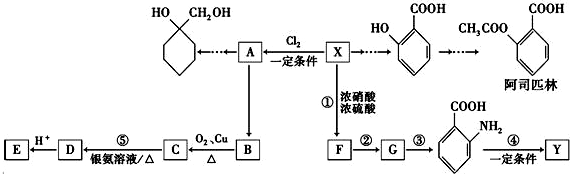
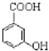 的名称为邻羟基苯甲酸,G中的官能团名称为硝基、羧基.
的名称为邻羟基苯甲酸,G中的官能团名称为硝基、羧基.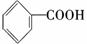 ;
;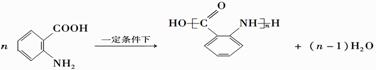 ;
;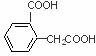 、
、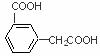 、
、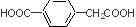
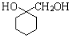 的合成路线流程图 (无机试剂任用).
的合成路线流程图 (无机试剂任用).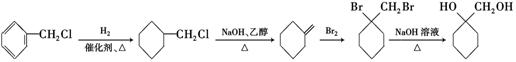 .
.