题目内容
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积。该小组设计的简易实验装置如图所示:
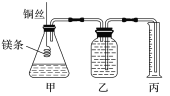
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100 mL 1.0 mol·L-1的盐酸(需要用到的仪器有:量筒、玻璃棒、烧杯、____________;
②用10 mL的量筒量取8.0 mL 1.0 mol·L-1的盐酸加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为___________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题:
(1)步骤①中,配制100 mL 1.0 mol·L-1的盐酸时,下列会使所配制溶液的浓度偏小的操作有_________(填字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度线
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线未做处理
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
G.未冷却至室温即定容
(2)请填写操作步骤中的空格:
步骤①:_________________________;
步骤③:________________________。
(3)实验步骤⑤中应选用的量筒规格是_______。
(4)读数时除需要恢复至室温外,还需要注意(回答一点即可):___________________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=________L·mol-1。
【答案】AC 100 mL容量瓶、胶头滴管 0.096 100 mL 调节量筒高度,使量筒内的液面与集气瓶内的液面相平;或读数时视线应与量筒中液体的凹液面最低处保持相平(任写一点即可) 0.25V
【解析】
(1)依据c=![]() 分析溶液体积和溶质的物质的量是否发生变化分析解答;
分析溶液体积和溶质的物质的量是否发生变化分析解答;
(2)步骤①为用已知浓度的浓盐酸配制100 mL 1.0 mol·L-1的盐酸,需要用到的仪器有量筒、玻璃棒、烧杯、100 mL容量瓶、胶头滴管;步骤③为去膜镁条与盐酸反应,因8.0 mL 1.0 mol·L-1盐酸中HCl的物质的量为0.008mol,依据化学方程式计算a的数值;
(3) 实验中产生的气体在标准状况下的体积为0.004mol×22.4 L/mol=0.0896L=89.6mL,25 ℃、101 kPa时氢气体积大于89.6mL,小于100 mL;
(4)读数时除需要恢复至室温外,还需要注意应调节量筒高度,使量筒内的液面与集气瓶中液面相平,保证气压相等,同时注意视线应与量筒中液体的凹液面最低处保持相平,不能仰视或俯视;
(5)由排出水的体积为气体体积结合n=![]() 计算可得。
计算可得。
(1)A、用量筒量取浓盐酸时,俯视量筒的刻度会使所量取溶液的体积减小,所配制的溶液的浓度偏小,故正确;
B、容量瓶未干燥即用来配制溶液对所配制的溶液的浓度没有影响,故错误;
C、未洗涤烧杯和玻璃棒,则n偏小,会使配制浓度偏低,故正确;
D、定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配制的溶液的浓度有影响,故错误;
E、在容量瓶中定容时俯视容量瓶刻度线,会使容量瓶中的液体的体积偏小,所配制的溶液浓度偏大,故E错误;
F、烧杯中有少量水对配制的溶液的浓度无关,故F错误;
AC正确,故答案为AC;
(2)步骤①为用已知浓度的浓盐酸配制100 mL 1.0 mol·L-1的盐酸,需要用到的仪器有量筒、玻璃棒、烧杯、100 mL容量瓶、胶头滴管;步骤③为去膜镁条与盐酸反应,因8.0 mL 1.0 mol·L-1盐酸中HCl的物质的量为0.008mol,由盐酸与镁反应的化学方程式Mg+2HCl=MgCl2+H2↑可知,0.008mol HCl可与0.004mol Mg完全反应,为保证HCl完全反应,故镁应不少于0.004mol×24 g/mol=0.096g。故答案为100 mL容量瓶、胶头滴管;0.096;
(3) 实验中产生的气体在标准状况下的体积为0.004mol×22.4 L/mol=0.0896L=89.6mL,25 ℃、101 kPa时氢气体积大于89.6mL,小于100 mL,则步骤⑤中应选用的量筒规格是100 mL,故答案为100 mL;
(4)读数时除需要恢复至室温外,还需要注意应调节量筒高度,使量筒内的液面与集气瓶中液面相平,保证气压相等,同时注意视线应与量筒中液体的凹液面最低处保持相平,不能仰视或俯视,故答案为调节量筒高度,使量筒内的液面与集气瓶内的液面相平;或读数时视线应与量筒中液体的凹液面最低处保持相平;
(5)排出水的体积为气体体积,气体的体积为VmL,实验中产生的气体的物质的量为0.004mol,则25 ℃、101 kPa时气体摩尔体积Vm=![]() =0.25VL/mol,故答案为0.25V。
=0.25VL/mol,故答案为0.25V。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案