题目内容
18. 利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
利用下列反应:Fe+2Fe3+═3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向.
分析 根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+.
解答 解:根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,可为氯化铁或硫酸铁等,装置图为 ,
,
故答案为: .
.
点评 本题考查原电池的设计和工作原理的探究,侧重于基础知识的考查,题目难度不大,注意把握原电池的组成和原理,学习中注意基础知识的积累.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
9.在如图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )


| A. | 苹果块会干瘪 | B. | 胆矾晶体表面有“白斑” | ||
| C. | 小试管内有KNO3晶体析出 | D. | 蓝色石蕊试纸变红 |
6.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
13.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如表:
由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  | 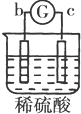 | 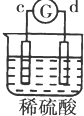 | 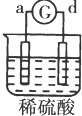 |
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
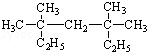 系统命名为3,3,5,5-四甲基庚烷
系统命名为3,3,5,5-四甲基庚烷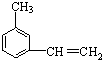
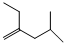 .
.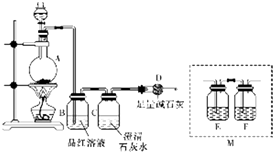 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.

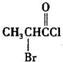 、
、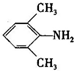 是合成施安卡因(
是合成施安卡因(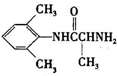 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: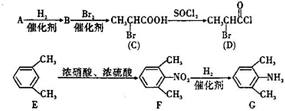 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.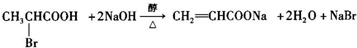 ;
;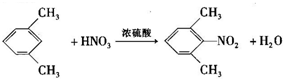 ;
; ;
;